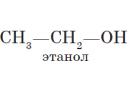Benseenrõngas ch2 oh. Isomerism, mis on iseloomulik orgaanilistele ühenditele, mille molekulid sisaldavad benseenitsüklit. Nomenklatuur ja isomeeria
Küllastunud ühe- ja mitmehüdroksüülsete alkoholide iseloomulikud keemilised omadused, fenool
Küllastunud ühe- ja mitmehüdroksüülsed alkoholid
Alkoholid (või alkanoolid) on orgaanilised ained, mille molekulid sisaldavad ühte või mitut hüdroksüülrühma ($—OH$ rühma), mis on seotud süsivesinikradikaaliga.
Hüdroksüülrühmade arvu (aatomilisuse) alusel jaotatakse alkoholid:
- üheaatomiline, näiteks:
$(CH_3-OH)↙(metanool(metüülalkohol))$ $(CH_3-CH_2-OH)↙(etanool(etüülalkohol))$
— kahehüdroksüülsed (glükoolid), Näiteks:
$(OH-CH_2-CH_2-OH)↙(etaandiool-1,2(etüleenglükool))$
$(HO-CH_2-CH_2-CH_2-OH)↙(propaandiool-1,3)$
— kolmeaatomiline, Näiteks:
Sõltuvalt süsivesinikradikaali olemusest eristatakse järgmisi alkohole:
— piiri mis sisaldavad molekulis ainult küllastunud süsivesinikradikaale, näiteks:

— piiramatu mis sisaldavad molekulis mitut (kaksik- ja kolmiksidet) süsinikuaatomite vahel, näiteks:
$(CH_2=CH-CH_2-OH)↙(propeen-2-ool-1 (allüülalkohol))$
— aromaatne, st. alkoholid, mis sisaldavad molekulis benseenitsüklit ja hüdroksüülrühma, mis on omavahel seotud mitte otse, vaid süsinikuaatomite kaudu, näiteks:

Molekulis hüdroksüülrühmi sisaldavad orgaanilised ained, mis on seotud otse benseenitsükli süsinikuaatomiga, erinevad keemiliste omaduste poolest oluliselt alkoholidest ja klassifitseeritakse seetõttu iseseisvaks orgaaniliste ühendite klassiks – fenoolideks. Näiteks:

Samuti leidub molekulis rohkem kui kolme hüdroksüülrühma sisaldavaid mitmehüdroksüülseid (mitmehüdroksüülseid) alkohole. Näiteks kõige lihtsam heksahüdroalkohol heksaool (sorbitool):

Nomenklatuur ja isomeeria
Alkoholide nimetuste moodustamisel lisatakse alkoholile vastava süsivesiniku nimele üldliide -ol. Sufiksi järel olevad numbrid näitavad hüdroksüülrühma asukohta peaahelas ja eesliiteid di-, tri-, tetra- jne - nende number:

Peaahela süsinikuaatomite nummerdamisel on hüdroksüülrühma positsioon ülimuslik mitme sideme positsiooni suhtes:

Alates homoloogse seeria kolmandast liikmest on alkoholidel funktsionaalrühma (propanool-1 ja propanool-2) positsiooni isomeeria ja neljandast süsinikskeleti (butanool-1, 2-metüülpropanool-1) isomeeria. ). Neid iseloomustab ka klassidevaheline isomeeria - alkoholid on eetrite suhtes isomeersed:
$(CH_3-CH_2-OH)↙(etanool)$ $(CH_3-O-CH_3)↙(dimetüüleeter)$
alkoholid
Füüsikalised omadused.
Alkoholid võivad moodustada vesiniksidemeid nii alkoholimolekulide kui ka alkoholi ja vee molekulide vahel.
Vesiniksidemed tekivad siis, kui ühe alkoholimolekuli osaliselt positiivselt laetud vesinikuaatom interakteerub teise molekuli osaliselt negatiivselt laetud hapnikuaatomiga. Tänu molekulidevahelistele vesiniksidemetele on alkoholide keemistemperatuurid nende molekulmassi kohta ebatavaliselt kõrged. Seega on propaan suhtelise molekulmassiga 44 $ tavatingimustes gaas ja lihtsaim alkoholidest metanool, mille suhteline molekulmass on $ 32, on tavatingimustes vedelik.
Küllastunud ühehüdroksüülsete alkoholide seeria alumised ja keskmised liikmed, mis sisaldavad 1–11 dollari süsinikuaatomeid, on vedelikud. Kõrgemad alkoholid (alates $C_(12)H_(25)OH$) on toatemperatuuril tahked ained. Madalamatel alkoholidel on iseloomulik alkoholilõhn ja terav maitse, nad lahustuvad vees hästi. Süsivesiniku radikaali suurenedes alkoholide lahustuvus vees väheneb ja oktanool ei segune enam veega.
Keemilised omadused.
Orgaaniliste ainete omadused määratakse nende koostise ja struktuuri järgi. Alkoholid kinnitavad üldreeglit. Nende molekulide hulka kuuluvad süsivesinik- ja hüdroksüülradikaalid, seega määrab alkoholide keemilised omadused nende rühmade vastastikmõju ja mõju üksteisele. Sellele ühendite klassile iseloomulikud omadused tulenevad hüdroksüülrühma olemasolust.
1. Alkoholide koostoime leelis- ja leelismuldmetallidega. Et teha kindlaks süsivesinikradikaali mõju hüdroksüülrühmale, on vaja võrrelda ühelt poolt hüdroksüülrühma ja süsivesinikradikaali sisaldava aine ning hüdroksüülrühma sisaldava ja süsivesinikradikaali mittesisaldava aine omadusi. , teiselt poolt. Sellised ained võivad olla näiteks etanool (või muu alkohol) ja vesi. Alkoholimolekulide ja veemolekulide hüdroksüülrühma vesinik on võimeline redutseerima leelis- ja leelismuldmetallidega (nendega asendatud):
$2Na+2H_2O=2NaOH+H_2$,
$2Na+2C_2H_5OH=2C_2H_5ONa+H_2$,
$2Na+2ROH=2RONa+H_2$.
2. Alkoholide koostoime vesinikhalogeniididega. Hüdroksüülrühma asendamine halogeeniga põhjustab haloalkaanide moodustumist. Näiteks:
$C_2H_5OH+HBr⇄C_2H_5Br+H_2O$.
See reaktsioon on pöörduv.
3. Alkoholide molekulidevaheline dehüdratsioon— veemolekuli eraldamine kahest alkoholimolekulist, kui seda kuumutatakse vett eemaldavate ainete juuresolekul:
Alkoholide molekulidevahelise dehüdratsiooni tulemusena eetrid. Seega, kui etüülalkoholi kuumutatakse väävelhappega temperatuurini $100 kuni $140°C, moodustub dietüül(väävel)eeter:
4. Alkoholide koostoime orgaaniliste ja anorgaaniliste hapetega estrite moodustamiseks ( esterdamisreaktsioon):
Esterdamisreaktsiooni katalüüsivad tugevad anorgaanilised happed.
Näiteks etüülalkoholi ja äädikhappe reageerimisel moodustub etüülatsetaat - etüülatsetaat:

5. Alkoholide intramolekulaarne dehüdratsioon tekib siis, kui alkohole kuumutatakse vett eemaldavate ainete juuresolekul kõrgemale temperatuurile kui molekulidevahelise dehüdratsiooni temperatuur. Selle tulemusena moodustuvad alkeenid. See reaktsioon on tingitud vesinikuaatomi ja hüdroksüülrühma olemasolust külgnevates süsinikuaatomites. Näide on eteeni (etüleeni) tootmise reaktsioon, kuumutades etanooli kontsentreeritud väävelhappe juuresolekul üle 140 °C:
6. Alkoholide oksüdatsioon tavaliselt viiakse läbi tugevate oksüdeerivate ainetega, näiteks kaaliumdikromaadi või kaaliumpermanganaadiga happelises keskkonnas. Sel juhul on oksüdeerija toime suunatud süsinikuaatomile, mis on juba hüdroksüülrühmaga seotud. Sõltuvalt alkoholi olemusest ja reaktsioonitingimustest võib moodustuda mitmesuguseid tooteid. Seega oksüdeeritakse esmalt primaarsed alkoholid aldehüüdid ja siis sisse karboksüülhapped:
Sekundaarsete alkoholide oksüdeerimisel tekivad ketoonid:

Tertsiaarsed alkoholid on oksüdatsioonile üsna vastupidavad. Kuid karmides tingimustes (tugev oksüdeerija, kõrge temperatuur) on võimalik tertsiaarsete alkoholide oksüdatsioon, mis toimub hüdroksüülrühmale kõige lähemal olevate süsinik-süsinik sidemete purunemisel.
7. Alkoholide dehüdrogeenimine. Kui alkoholiaur juhitakse temperatuuril 200–300 °C üle metallkatalüsaatori, nagu vask, hõbe või plaatina, muundatakse primaarsed alkoholid aldehüüdideks ja sekundaarsed alkoholid ketoonideks:

Mitme hüdroksüülrühma samaaegne olemasolu alkoholimolekulis määrab spetsiifilised omadused mitmehüdroksüülsed alkoholid, mis on võimelised moodustama vees lahustuvaid helesiniseid kompleksühendeid, kui nad interakteeruvad värskelt valmistatud vask(II)hüdroksiidi sademega. Etüleenglükooli kohta võime kirjutada:
Ühehüdroksüülsed alkoholid ei saa selles reaktsioonis osaleda. Seetõttu on see kvalitatiivne reaktsioon mitmehüdroksüülsetele alkoholidele.
fenool
Fenoolide struktuur
Hüdroksüülrühm orgaaniliste ühendite molekulides võib olla otseselt seotud aromaatse ringiga või olla sellest eraldatud ühe või mitme süsinikuaatomiga. Võib eeldada, et olenevalt sellest omadusest erinevad ained üksteisest oluliselt aatomirühmade vastastikuse mõju tõttu. Tõepoolest, aromaatset fenüülradikaali $C_6H_5$- sisaldavad orgaanilised ühendid, mis on otseselt seotud hüdroksüülrühmaga, omavad erilisi omadusi, mis erinevad alkoholide omadustest. Selliseid ühendeid nimetatakse fenoolideks.
Fenoolid on orgaanilised ained, mille molekulid sisaldavad ühe või mitme hüdroksorühmaga seotud fenüülradikaali.
Nii nagu alkoholid, liigitatakse fenoole nende aatomilisuse järgi, s.t. hüdroksüülrühmade arvu järgi.
Ühehüdroksüülsed fenoolid sisaldavad molekulis ühte hüdroksüülrühma:

Mitmehüdroksüülsed fenoolid sisaldavad molekulides rohkem kui ühte hüdroksüülrühma:

On ka teisi mitmehüdroksüülseid fenoole, mis sisaldavad benseenitsüklis kolme või enamat hüdroksüülrühma.
Vaatame lähemalt selle klassi lihtsaima esindaja - fenooli $C_6H_5OH$ - struktuuri ja omadusi. Selle aine nimi oli aluseks kogu klassi nimele - fenoolid.
Füüsilised ja keemilised omadused.
Füüsikalised omadused.
Fenool on terava iseloomuliku lõhnaga tahke, värvitu, kristalne aine, $t°_(pl.)=43°C, t°_(keemistemperatuur)=181°C$. Mürgine. Fenool lahustub toatemperatuuril vees vähe. Fenooli vesilahust nimetatakse karboolhappeks. Nahale sattudes põhjustab see põletushaavu, seega tuleb fenooliga ümber käia ettevaatlikult!
Keemilised omadused.
Happelised omadused. Nagu juba mainitud, on hüdroksüülrühma vesinikuaatom oma olemuselt happeline. Fenooli happelised omadused on rohkem väljendunud kui vee ja alkoholide omad. Erinevalt alkoholidest ja veest reageerib fenool mitte ainult leelismetallidega, vaid ka leelistega, moodustades fenolaadid:

Fenoolide happelised omadused on aga vähem väljendunud kui anorgaanilistel ja karboksüülhapetel. Näiteks on fenooli happelised omadused ligikaudu 3000 $ korda nõrgemad kui süsihappel. Seetõttu saab süsinikdioksiidi juhtimisel läbi naatriumfenolaadi vesilahuse eraldada vaba fenooli:

Vesinikkloriid- või väävelhappe lisamine naatriumfenolaadi vesilahusele põhjustab samuti fenooli moodustumist:

Kvalitatiivne reaktsioon fenoolile.
Fenool reageerib raud(III)kloriidiga, moodustades intensiivselt purpurse kompleksühendi.
See reaktsioon võimaldab seda tuvastada isegi väga piiratud kogustes. Teised fenoolid, mis sisaldavad benseenitsüklis ühte või mitut hüdroksüülrühma, tekitavad raud(III)kloriidiga reageerimisel ka eredaid sinakasvioletseid värvusi.
Benseenitsükli reaktsioonid.
Hüdroksüülasendaja olemasolu hõlbustab oluliselt elektrofiilsete asendusreaktsioonide toimumist benseenitsüklis.
1. Fenooli broomimine. Erinevalt benseenist ei vaja fenooli broomimine katalüsaatori (raud(III)bromiidi) lisamist.
Lisaks toimub interaktsioon fenooliga valikuliselt: broomi aatomid on suunatud orto- ja para positsioonid, asendades seal asuvad vesinikuaatomid. Asenduse selektiivsust seletatakse eespool käsitletud fenooli molekuli elektroonilise struktuuri tunnustega.
Seega, kui fenool reageerib broomveega, moodustub valge sade 2,4,6-tribromofenool:

See reaktsioon, nagu reaktsioon raud(III)kloriidiga, on mõeldud fenooli kvalitatiivseks tuvastamiseks.
2. Fenooli nitreerimine toimub ka kergemini kui benseeni nitreerimine. Reaktsioon lahjendatud lämmastikhappega toimub toatemperatuuril. Selle tulemusena moodustub segu orto- Ja paar- nitrofenooli isomeerid:

Kontsentreeritud lämmastikhappe kasutamisel tekib lõhkeaine - 2,4,6-trinitrofenool(pikriinhape):

3. Fenooli aromaatse tuuma hüdrogeenimine katalüsaatori juuresolekul toimub kergesti:

4.Fenooli polükondensatsioon aldehüüdidega, eriti formaldehüüdiga, tekib reaktsioonisaaduste - fenoolformaldehüüdvaikude ja tahkete polümeeride - moodustumisel.
Fenooli ja formaldehüüdi koostoimet saab kirjeldada järgmise skeemi abil:

Tõenäoliselt märkasite, et dimeeri molekulis säilivad "liikuvad" vesinikuaatomid, mis tähendab, et reaktsiooni edasine jätkamine on võimalik piisava arvu reaktiividega:

Reaktsioon polükondensatsioon, need. polümeeri tootmisreaktsioon, mis tekib väikese molekulmassiga kõrvalsaaduse (vee) vabanemisel, võib jätkuda (kuni üks reagentidest on täielikult kulunud) tohutute makromolekulide moodustumisega. Protsessi saab kirjeldada koondvõrrandiga:

Lineaarsete molekulide moodustumine toimub tavalistel temperatuuridel. Selle reaktsiooni läbiviimine kuumutamisel toob kaasa asjaolu, et saadud tootel on hargnenud struktuur, see on tahke ja vees lahustumatu. Lineaarse fenoolformaldehüüdvaigu kuumutamisel aldehüüdi liiaga saadakse ainulaadsete omadustega kõvad plastmassid. Fenoolformaldehüüdvaikudel põhinevaid polümeere kasutatakse lakkide ja värvide, kuumenemisele, jahutamisele, veele, leelistele ja hapetele vastupidavate ning kõrgete dielektriliste omadustega plasttoodete valmistamiseks. Elektriseadmete kõige kriitilisemad ja olulisemad osad, toiteplokkide korpused ja masinaosad ning raadioseadmete trükkplaatide polümeerpõhi on valmistatud fenool-formaldehüüdvaikudel põhinevatest polümeeridest. Fenoolformaldehüüdvaikudel põhinevad liimid on võimelised usaldusväärselt ühendama väga erinevat laadi osi, säilitades vuugi kõrgeima tugevuse väga laias temperatuurivahemikus. Seda liimi kasutatakse valgustuslampide metallaluse kinnitamiseks klaaspirni külge. Nüüd saate aru, miks fenooli ja sellel põhinevaid tooteid laialdaselt kasutatakse.
Aldehüüdide, küllastunud karboksüülhapete, estrite iseloomulikud keemilised omadused
Aldehüüdid ja ketoonid
Aldehüüdid on orgaanilised ained, mille molekulid sisaldavad karbonüülrühma  , mis on ühendatud vesinikuaatomi ja süsivesiniku radikaaliga.
, mis on ühendatud vesinikuaatomi ja süsivesiniku radikaaliga.
Aldehüüdide üldvalem on:

Lihtsaimas aldehüüdis, formaldehüüdis, mängib süsivesiniku radikaali rolli teine vesinikuaatom:

Karbonüülrühma, mis on seotud vesinikuaatomiga, nimetatakse aldehüüd:

Orgaanilisi aineid, mille molekulides on karbonüülrühm seotud kahe süsivesinikradikaaliga, nimetatakse ketoonideks.
Ilmselt on ketoonide üldine valem:

Ketoonide karbonüülrühma nimetatakse keto rühm.
Lihtsaimas ketoonis, atsetoonis, on karbonüülrühm seotud kahe metüülradikaaliga:

Nomenklatuur ja isomeeria
Sõltuvalt aldehüüdrühmaga seotud süsivesinikradikaali struktuurist eristatakse küllastunud, küllastumata, aromaatseid, heterotsüklilisi ja muid aldehüüde:

Vastavalt IUPAC nomenklatuurile moodustatakse küllastunud aldehüüdide nimetused molekulis sama arvu süsinikuaatomite arvuga alkaani nimest, kasutades järelliidet. -al. Näiteks:
Peaahela süsinikuaatomite numeratsioon algab aldehüüdrühma süsinikuaatomiga. Seetõttu asub aldehüüdrühm alati esimese süsinikuaatomi juures ja selle asukohta pole vaja näidata.
Koos süstemaatilise nomenklatuuriga kasutatakse ka laialdaselt kasutatavate aldehüüdide triviaalseid nimetusi. Need nimetused on tavaliselt tuletatud aldehüüdidele vastavate karboksüülhapete nimedest.
Ketoonide nimetamiseks süstemaatilise nomenklatuuri järgi tähistatakse ketorühma järelliitega - Tema ja number, mis näitab karbonüülrühma süsinikuaatomi arvu (numeratsioon peaks algama ketorühmale lähimast ahela lõpust). Näiteks:
Aldehüüde iseloomustab ainult üht tüüpi struktuurne isomeeria - süsinikskeleti isomeeria, mis on võimalik butanaaliga, ja ketoonide puhul - ka karbonüülrühma positsiooni isomeeria. Lisaks iseloomustab neid klassidevaheline isomeeria (propanaal ja propanoon).
Mõnede aldehüüdide triviaalsed nimetused ja keemistemperatuurid.
Füüsilised ja keemilised omadused
Füüsikalised omadused.
Aldehüüdi või ketooni molekulis on hapnikuaatomi suurema elektronegatiivsuse tõttu süsinikuaatomiga võrreldes $C=O$ side tugevalt polariseeritud, kuna $π$ sideme elektrontihedus nihkub hapniku suunas:

Aldehüüdid ja ketoonid on polaarsed ained, mille hapnikuaatomil on liigne elektrontihedus. Aldehüüdide ja ketoonide seeria alumised liikmed (formaldehüüd, atseetaldehüüd, atsetoon) lahustuvad vees piiramatult. Nende keemistemperatuurid on madalamad kui vastavatel alkoholidel. See on tingitud asjaolust, et aldehüüdide ja ketoonide molekulides ei ole erinevalt alkoholidest liikuvaid vesinikuaatomeid ja nad ei moodusta vesiniksidemete tõttu assotsiatsioone. Madalamad aldehüüdid on terava lõhnaga; Aldehüüdidel, mis sisaldavad ahelas nelja kuni kuut süsinikuaatomit, on ebameeldiv lõhn; Kõrgematel aldehüüdidel ja ketoonidel on lillelõhn ja neid kasutatakse parfümeerias.
Keemilised omadused
Aldehüüdrühma olemasolu molekulis määrab aldehüüdidele iseloomulikud omadused.
Taastumisreaktsioonid.
Vesiniku lisamine Aldehüüdi molekulid toimub karbonüülrühma kaksiksideme kaudu:

Aldehüüdide hüdrogeenimise saadus on primaarsed alkoholid ja ketoonid on sekundaarsed alkoholid.
Seega, atseetaldehüüdi hüdrogeenimisel nikkelkatalüsaatoril moodustub etüülalkohol ja atsetooni hüdrogeenimisel propanool-2:

Aldehüüdide hüdrogeenimine - taastumisreaktsioon mille juures karbonüülrühma kuuluva süsinikuaatomi oksüdatsiooniaste väheneb.
Oksüdatsioonireaktsioonid.
Aldehüüde ei saa mitte ainult vähendada, vaid ka oksüdeerida. Oksüdeerumisel moodustavad aldehüüdid karboksüülhappeid. Seda protsessi saab skemaatiliselt kujutada järgmiselt:

Propioonaldehüüdist (propaanaalist) moodustub näiteks propioonhape:

Aldehüüde oksüdeerivad isegi õhuhapnik ja sellised nõrgad oksüdeerivad ained nagu hõbeoksiidi ammoniaagilahus. Lihtsustatud kujul saab seda protsessi väljendada reaktsioonivõrrandiga:
Näiteks:

Seda protsessi kajastavad täpsemalt võrrandid:
Kui anuma pind, milles reaktsioon läbi viiakse, on eelnevalt rasvatustatud, siis reaktsiooni käigus tekkinud hõbe katab selle ühtlase õhukese kilega. Seetõttu nimetatakse seda reaktsiooni reaktsiooniks "hõbedane peegel". Seda kasutatakse laialdaselt peeglite, hõbeda- ja jõulupuu kaunistuste valmistamiseks.
Värskelt sadestunud vask(II)hüdroksiid võib toimida ka aldehüüdide oksüdeeriva ainena. Aldehüüdi oksüdeerimisel redutseeritakse $Cu^(2+)$ väärtuseks $Cu^+$. Reaktsiooni käigus tekkinud vask(I)hüdroksiid $CuOH$ laguneb koheselt punaseks vask(I)oksiidiks ja veeks:
Seda reaktsiooni, nagu ka hõbepeegli reaktsiooni, kasutatakse aldehüüdide tuvastamiseks.
Ketoone ei oksüdeeri ei õhuhapnik ega selline nõrk oksüdeeriv aine nagu hõbeoksiidi ammoniaagilahus.
Aldehüüdide üksikud esindajad ja nende tähendus
Formaldehüüd(metanaal, formikaldehüüd$HCHO$ ) - värvitu terava lõhnaga gaas, mille keemistemperatuur on -21 °C, vees hästi lahustuv. Formaldehüüd on mürgine! Formaldehüüdi lahust vees ($ 40% $) nimetatakse formaldehüüdiks ja seda kasutatakse desinfitseerimiseks. Põllumajanduses kasutatakse formaldehüüdi seemnete töötlemiseks ja nahatööstuses - naha töötlemiseks. Formaldehüüdi kasutatakse raviaine meteenamiini tootmiseks. Mõnikord kasutatakse kütusena (kuiv alkohol) brikettide kujul kokkupressitud meteenamiini. Fenoolformaldehüüdvaikude ja mõnede muude ainete tootmisel kulub suur hulk formaldehüüdi.
Atsetaldehüüd(etanaal, atseetaldehüüd$CH_3CHO$ ) - terava ebameeldiva lõhnaga vedelik, mille keemistemperatuur on 21°C$, vees hästi lahustuv. Äädikhapet ja mitmeid teisi aineid toodetakse atseetaldehüüdist tööstuslikus mastaabis, seda kasutatakse erinevate plastide ja atsetaatkiudude tootmiseks. Atseetaldehüüd on mürgine!
Karboksüülhapped
Aineid, mis sisaldavad ühte või mitut karboksüülrühma molekulis, nimetatakse karboksüülhapeteks.
Aatomite rühm  helistas karboksüülrühm, või karboksüül.
helistas karboksüülrühm, või karboksüül.
Orgaanilised happed, mis sisaldavad molekulis ühte karboksüülrühma, on ühealuseline.
Nende hapete üldvalem on $RCOOH$, näiteks:

Karboksüülhappeid, mis sisaldavad kahte karboksüülrühma, nimetatakse kahealuseline. Nende hulka kuuluvad näiteks oksaal- ja merevaikhape:
Samuti on olemas mitmealuseline karboksüülhapped, mis sisaldavad rohkem kui kahte karboksüülrühma. Nende hulka kuuluvad näiteks kolmealuseline sidrunhape:

Sõltuvalt süsivesinikradikaali olemusest jagatakse karboksüülhapped küllastunud, küllastumata, aromaatseks.
Küllastunud või küllastunud karboksüülhapped on näiteks propaanhape (propioonhape):

või juba tuttav merevaikhape.
On ilmne, et küllastunud karboksüülhapped ei sisalda süsivesinikradikaalis $π$ sidemeid. Küllastumata karboksüülhapete molekulides on karboksüülrühm seotud küllastumata, küllastumata süsivesinikradikaaliga, näiteks akrüüli (propeeni) molekulides $CH_2=CH-COOH$ või oleiinhappe $CH_3-(CH_2)_7-CH=CH —(CH_2)_7—COOH $ ja muud happed.
Nagu bensoehappe valemist näha, on see aromaatne, kuna sisaldab molekulis aromaatset (benseeni) ringi:

Nomenklatuur ja isomeeria
Karboksüülhapete, aga ka teiste orgaaniliste ühendite nimetuste moodustamise üldpõhimõtteid on juba käsitletud. Vaatleme üksikasjalikumalt ühe- ja kahealuseliste karboksüülhapete nomenklatuuri. Karboksüülhappe nimi on tuletatud vastava alkaani (molekulis sama arvu süsinikuaatomite arvuga alkaani) nimest, millele on lisatud järelliide. -ov-, lõpud -ja mina ja sõnad hape. Süsinikuaatomite nummerdamine algab karboksüülrühmast. Näiteks:

Karboksüülrühmade arv on nimes märgitud eesliidetega di-, tri-, tetra-:
Paljudel hapetel on ka ajalooliselt väljakujunenud või triviaalsed nimed.
Karboksüülhapete nimetused.
| Keemiline valem | Happe süstemaatiline nimetus | Triviaalne happe nimi |
| $H-COOH$ | metaan | Ant |
| $CH_3–COOH$ | Ethanova | Äädikas |
| $CH_3—CH_2—COOH$ | Propaan | Propioonhape |
| $CH_3—CH_2—CH_2—COOH$ | butaan | Õline |
| $CH_3—CH_2—CH_2—CH_2—COOH$ | Pentanic | Palderjan |
| $CH_3—(CH_2)_4—COOH$ | Heksaan | Nailon |
| $CH_3—(CH_2)_5—COOH$ | Heptaan | Enantiline |
| $NOOC—COOH$ | Etaanium | Hapuoblikas |
| $NOOC—CH_2—COOH$ | Propaan | Malonovaya |
| $NOOC—CH_2—CH_2—COOH$ | Butaandiovye | Merevaik |
Pärast orgaaniliste hapete mitmekesise ja huvitava maailmaga tutvumist käsitleme üksikasjalikumalt küllastunud ühealuselisi karboksüülhappeid.
On selge, et nende hapete koostist väljendatakse üldvalemiga $C_nH_(2n)O_2$ või $C_nH_(2n+1)COOH$ või $RCOOH$.
Füüsilised ja keemilised omadused
Füüsikalised omadused.
Madalamad happed, s.o. suhteliselt väikese molekulmassiga happed, mis sisaldavad kuni neli süsinikuaatomit molekuli kohta, on iseloomuliku terava lõhnaga vedelikud (pidage meeles äädikhappe lõhna). $4–9$ süsinikuaatomeid sisaldavad happed on viskoossed õlised vedelikud, millel on ebameeldiv lõhn; sisaldavad rohkem kui 9 $ süsinikuaatomit molekuli kohta – tahked ained, mis ei lahustu vees. Küllastunud ühealuseliste karboksüülhapete keemistemperatuurid tõusevad koos süsinikuaatomite arvu suurenemisega molekulis ja sellest tulenevalt suhtelise molekulmassi suurenemisega. Näiteks sipelghappe keemistemperatuur on $100,8°C$, äädikhappe keemistemperatuur on $118°C$ ja propioonhappe keemistemperatuur on $141°C$.
Lihtsaim karboksüülhape on sipelghape $HCOOH$, mille suhteline molekulmass on $(M_r(HCOOH)=46)$, tavatingimustes on see vedelik keemistemperatuuriga $100,8°C$. Samal ajal on butaan $(M_r(C_4H_(10))=58)$ samadel tingimustel gaasiline ja selle keemistemperatuur on $-0,5°C$. Keemispunktide ja suhteliste molekulmasside lahknevus on seletatav karboksüülhappe dimeeride moodustumisega, milles kaks happemolekuli on seotud kahe vesiniksidemega:

Vesiniksidemete esinemine saab selgeks karboksüülhappemolekulide struktuuri arvestades.
Küllastunud ühealuseliste karboksüülhapete molekulid sisaldavad polaarset aatomirühma - karboksüülrühma  ja praktiliselt mittepolaarne süsivesinikradikaal. Karboksüülrühm tõmbab veemolekule, moodustades nendega vesiniksidemeid:
ja praktiliselt mittepolaarne süsivesinikradikaal. Karboksüülrühm tõmbab veemolekule, moodustades nendega vesiniksidemeid:

Sipelg- ja äädikhape lahustuvad vees piiramatult. On ilmne, et süsivesinikradikaali aatomite arvu suurenemisega karboksüülhapete lahustuvus väheneb.
Keemilised omadused.
Hapete klassile (nii orgaanilistele kui anorgaanilistele) iseloomulikud üldised omadused tulenevad vesiniku- ja hapnikuaatomite vahel tugevat polaarset sidet sisaldava hüdroksüülrühma olemasolust molekulides. Vaatleme neid omadusi vees lahustuvate orgaaniliste hapete näitel.
1. Dissotsiatsioon vesinikkatioonide ja happejäägi anioonide moodustumisega:
$CH_3-COOH⇄CH_3-COO^(-)+H^+$
Täpsemalt kirjeldab seda protsessi võrrand, mis võtab arvesse veemolekulide osalemist selles:
$CH_3-COOH+H_2O⇄CH_3COO^(-)+H_3O^+$
Karboksüülhapete dissotsiatsioonitasakaalu nihutatakse vasakule; valdav enamus neist on nõrgad elektrolüüdid. Näiteks äädik- ja sipelghapete hapu maitse on aga tingitud dissotsiatsioonist vesinikkatioonideks ja happejääkide anioonideks.
On ilmne, et “happelise” vesiniku esinemine karboksüülhapete molekulides, s.o. karboksüülrühma vesinik, muude iseloomulike omaduste tõttu.
2. Koostoime metallidega, seisab elektrokeemilises pingereas kuni vesinikuni: $nR-COOH+M→(RCOO)_(n)M+(n)/(2)H_2$
Seega redutseerib raud äädikhappest vesinikku:
$2CH_3-COOH+Fe→(CH_3COO)_(2)Fe+H_2$
3. Koostoime aluseliste oksiididega soola ja vee moodustumisega:
$2R-COOH+CaO→(R-COO)_(2)Ca+H_2O$
4. Koostoime metallhüdroksiididega soola ja vee moodustumisega (neutraliseerimisreaktsioon):
$R—COOH+NaOH→R—COONa+H_2O$,
$2R—COOH+Ca(OH)_2→(R—COO)_(2)Ca+2H_2O$.
5. Koostoime nõrgemate hapete sooladega viimase tekkega. Seega tõrjub äädikhape välja steariinhappe naatriumstearaadist ja süsihappe kaaliumkarbonaadist:
$CH_3COOH+C_(17)H_(35)COONa→CH_3COONa+C_(17)H_(35)COOH↓$,
$2CH_3COOH+K_2CO_3→2CH_3COOK+H_2O+CO_2$.
6. Karboksüülhapete koostoime alkoholidega estrite moodustumisega - esterdamisreaktsioon (üks olulisemaid karboksüülhapetele iseloomulikke reaktsioone):
Karboksüülhapete koostoimet alkoholidega katalüüsivad vesiniku katioonid.
Esterdamisreaktsioon on pöörduv. Tasakaal nihkub estri moodustumise suunas veetustavate ainete juuresolekul ja kui ester eemaldatakse reaktsioonisegust.
Esterdamise pöördreaktsioonis, mida nimetatakse estri hüdrolüüsiks (estri reaktsioon veega), moodustuvad hape ja alkohol:
On ilmne, et reageerides karboksüülhapetega, s.o. Mitmehüdroksüülsed alkoholid, näiteks glütserool, võivad samuti osaleda esterdamisreaktsioonis:

Kõik karboksüülhapped (välja arvatud sipelghape) koos karboksüülrühmaga sisaldavad oma molekulides süsivesinike jääke. Loomulikult ei saa see muud kui mõjutada hapete omadusi, mille määrab süsivesinike jäägi olemus.
7. Liitmisreaktsioonid mitme sideme korral- need sisaldavad küllastumata karboksüülhappeid. Näiteks vesiniku liitumisreaktsioon on hüdrogeenimine. Happe puhul, mille radikaalis on üks $π$ side, saab võrrandi kirjutada üldkujul:
$C_(n)H_(2n-1)COOH+H_2(→)↖(katalüsaator)C_(n)H_(2n+1)COOH.$
Seega moodustub oleiinhappe hüdrogeenimisel küllastunud steariinhape:
$(C_(17)H_(33)COOH+H_2)↙(\tekst"oleiinhape"))(→)↖(katalüsaator)(C_(17)H_(35)COOH)↙(\tekst"steariinhape" ) $
Küllastumata karboksüülhapped, nagu ka teised küllastumata ühendid, lisavad halogeene kaksiksideme kaudu. Näiteks akrüülhape muudab broomivee värvituks:
$(CH_2=CH—COOH+Br_2)↙(\tekst"akrüül(propeen)hape")→(CH_2Br—CHBr—COOH)↙(\tekst"2,3-dibromopropaanhape").$
8. Asendusreaktsioonid (halogeenidega)- küllastunud karboksüülhapped on võimelised neisse sisenema. Näiteks äädikhappe klooriga reageerimisel võib saada erinevaid klooritud happeid:
$CH_3COOH+Cl_2(→)↖(P(punane))(CH_2Cl-COOH+HCl)↙(\tekst"kloroäädikhape")$,
$CH_2Cl-COOH+Cl_2(→)↖(P(punane))(CHCl_2-COOH+HCl)↙(\tekst"dikloroäädikhape")$,
$CHCl_2-COOH+Cl_2(→)↖(P(punane))(CCl_3-COOH+HCl)↙(\tekst"trikloroäädikhape")$
Karboksüülhapete üksikud esindajad ja nende tähendus
Ant(metaan) hape HTSOOKH- terava lõhnaga vedelik, mille keemistemperatuur on 100,8°C$, vees hästi lahustuv. Sipelghape on mürgine Nahale sattumisel põhjustab põletusi! Sipelgate eritatav nõelamisvedelik sisaldab seda hapet. Sipelghappel on desinfitseerivad omadused ja seetõttu kasutatakse seda toiduainete-, naha- ja farmaatsiatööstuses ning meditsiinis. Seda kasutatakse kangaste ja paberi värvimisel.
Äädikas (etaan)hape $CH_3COOH$ on iseloomuliku terava lõhnaga värvitu vedelik, mis seguneb veega mis tahes vahekorras. Äädikhappe vesilahuseid müüakse äädika (3–5% lahus) ja äädika essentsi (70–80% lahus) nimetuse all ning neid kasutatakse laialdaselt toiduainetööstuses. Äädikhape on hea lahusti paljudele orgaanilistele ainetele ja seetõttu kasutatakse seda värvimisel, parkimisel ning värvi- ja lakitööstuses. Lisaks on äädikhape tooraine paljude tehniliselt oluliste orgaaniliste ühendite tootmiseks: sellest saadakse näiteks umbrohutõrjeks kasutatavaid aineid – herbitsiidid.
Peamine komponent on äädikhape veiniäädikas, mille iseloomulik lõhn tuleneb just sellest. See on etanooli oksüdatsiooni produkt ja tekib sellest veini õhu käes hoidmisel.
Kõrgemate küllastunud ühealuseliste hapete olulisemad esindajad on palmiitne$C_(15)H_(31)COOH$ ja steariin$C_(17)H_(35)COOH$ hape. Erinevalt madalamatest hapetest on need ained tahked ja vees halvasti lahustuvad.
Nende soolad – stearaadid ja palmitaadid – on aga hästi lahustuvad ja peseva toimega, mistõttu neid nimetatakse ka seepideks. On selge, et neid aineid toodetakse suures mahus. Küllastumata kõrgematest karboksüülhapetest on kõige olulisem oleiinhape$C_(17)H_(33)COOH$ või $CH_3 - (CH_2)_7 - CH=CH-(CH_2)_7COOH$. See on õlitaoline vedelik, millel pole maitset ega lõhna. Selle sooli kasutatakse tehnoloogias laialdaselt.
Kahealuseliste karboksüülhapete lihtsaim esindaja on oksaalhape (etaandihape).$HOOC—COOH$, mille sooli leidub paljudes taimedes, nagu hapuoblikas ja hapuoblikas. Oksaalhape on värvitu kristalne aine, mis lahustub vees hästi. Seda kasutatakse metallide poleerimiseks, puidu- ja nahatööstuses.
Estrid
Kui karboksüülhapped interakteeruvad alkoholidega (esterdamisreaktsioon), tekivad need estrid:

See reaktsioon on pöörduv. Reaktsiooniproduktid võivad üksteisega interakteeruda, moodustades lähteaineid - alkoholi ja hapet. Seega on estrite reaktsioon veega – estri hüdrolüüs – esterdamisreaktsiooni vastupidine. Keemilist tasakaalu, mis tekib siis, kui päri- (esterdamine) ja pöördreaktsiooni (hüdrolüüs) kiirus on võrdne, saab vett eemaldavate ainete abil nihutada estri moodustumise suunas.
Rasvad- ühendite derivaadid, mis on glütserooli ja kõrgemate karboksüülhapete estrid.
Kõik rasvad, nagu ka teised estrid, läbivad hüdrolüüsi:

Kui rasva hüdrolüüs viiakse läbi aluselises keskkonnas $(NaOH)$ ja sooda $Na_2CO_3$ juuresolekul, kulgeb see pöördumatult ja põhjustab mitte karboksüülhapete, vaid nende soolade moodustumist, mida nimetatakse nn. seebid. Seetõttu nimetatakse rasvade hüdrolüüsi leeliselises keskkonnas seebistamine.
Asendajad CH 3, CH 2 R, CHR 2, CR 3, OH, OR, NH 2, NHR, NR 2, F, Cl, Br, I ja teised nimetatakse asendajateks esimene liik. Nad on võimelised loovutama elektrone on elektrone loovutavad asendajad.
Teist tüüpi asendajad võimelised elektrone välja tõmbama ja vastu võtma . Need on elektrone eemaldavad asendajad. Nende hulka kuuluvad SO 3 H, NO 2, COOH, COOR, CHO, COR, CN, NH 3 + ja teised.
Omakorda ründavad (asendus)rühmad võib olla elektrofiilne või nukleofiilsed. Elektrofiilsed reagendid toimivad reaktsioonis elektronide aktseptoritena. Konkreetsel juhul on see nii katioonid. Reaktsioonis osalevad nukleofiilsed reagendid on elektronidoonorid. Konkreetsel juhul on see nii anioonid.
Kui reaktiiv toimib ühe asendajaga tuumas, võib nende interaktsiooniks eristada mitmeid võimalusi:
– esimest liiki asetäitja; elektrofiilne reaktiiv.
Vaatleme näiteks tolueeni nitreerimise reaktsiooni nitreerimisseguga (lämmastik- ja väävelhappe segu).
Tolueenis olev metüülrühm on esimest tüüpi orienteeriv aine. See on elektronidoonori osake. Sellepärast tuum tervikuna elektronide tiheduse nihke tõttu metüülrühmast saab ta osalise negatiivse laengu. Negatiivselt laetud on ka asendajale lähima ringi süsinikuaatomid. Järgnevad süsinikud tsüklis omandavad vahelduvaid laenguid(vahelduv efekt). Nitreerimissegu lämmastik- ja väävelhappe vahelisel reaktsioonil tekib mitu osakest, mille hulgas on elektrofiilne osake NO 2 +(näidatud diagrammil sulgudes oleva noole kohal), mis ründab tsükli negatiivselt laetud aatomeid. Vesiniku aatomid on asendatud nitrorühmaga orto- Ja paar-positsioonid metüülrühma suhtes. Kuna tuumal on negatiivne laeng ja ründav osake on elektrofiilne(positiivselt laetud) on reaktsioon kergem ja see võib kulgeda leebemates tingimustes võrreldes benseeni nitreerimisega.
– teist liiki asetäitja; elektrofiilne reaktiiv.

Sulfoonrühm (teist tüüpi orientant, elektrone väljatõmbav) laeb elektrontiheduse enda poole nihkumise tõttu positiivselt tuuma kui terviku ja tuuma lähimad süsinikud. Ründav osake on elektrofiilne. Orienteerumine sisse meta-positsioon. Asendaja takistab reagendi toimet. Sulfoonimine tuleks läbi viia kontsentreeritud väävelhappega kõrgendatud temperatuuril.
– teist liiki asetäitja; Reaktiiv on nukleofiilne.

Vastavalt laengutele ründab nukleofiilne osake OK – orto- Ja paar-positsioonid ja asendaja hõlbustavad reagendi toimet. Sellegipoolest Nukleofiilsed asendusreaktsioonid tuleb läbi viia üsna karmides tingimustes. Seda seletatakse reaktsiooni üleminekuseisundi energeetilise ebasoodsusega ja sellega, et π -molekuli elektronpilv tõrjub ründava nukleofiilse osakese.
– esimese liigi asetäitja; Reaktiiv on nukleofiilne.
Asendaja takistab reagendi toimet. Orienteerumine sisse meta-positsioon. Selliseid reaktsioone praktiliselt ei realiseeru.

Kui tuumas on mitu erinevat asendajat, siis valdavat suunavat mõju avaldab see, millel on suurim orienteeriv mõju. Näiteks elektrofiilsetes asendusreaktsioonides Orienteeriva toime tugevuse põhjal saab asendajad paigutada järgmisele reale:
OH > NH 2 > OR > Cl > I > Br > CH 3; Teist tüüpi orientantide orienteerumisvõime väheneb järgmises järjestuses: NO 2 > COOH > SO 3 H. Kloorimisreaktsioon on toodud näitena orto-kresool (1-hüdroksü-2-metüülbenseen):

Mõlemad asendajad on esimest tüüpi, elektrone loovutavad orientandid. Otsustades süsinikuaatomite laengute järgi (sulgudes – rühmast –OH), ei lange orientatsioon kokku. Kuna fenoolhüdroksüül on tugevam orienteeriv aine, saadakse üldjuhul tooteid, mis vastavad selle rühma orientatsioonile. Mõlemad asendajad hõlbustavad reaktsiooni. Reaktsioon on elektrofiilne tänu katalüsaatori interaktsioonile molekulaarse klooriga.

Praktikas ei järgita asendusreegleid enamasti täpselt. Asendamine annab kõik võimalikud tooted. Kuid alati on rohkem tooteid, mida tuleb reeglite järgi toota. Näiteks tolueeni nitreerimine annab 62% orto-, 33,5 % paar- ja 4,5% meta-nitrotolueenid.
Muutused väliskeskkonnas (temperatuur, rõhk, katalüsaator, lahusti jne) mõjutavad orienteerumist tavaliselt vähe.
Orienteerumisreeglite selgitamisel on näidatud mitmeid asendusreaktsioone. Vaatame veel mõnda reaktsiooni.
– Kui benseen puutub kokku kloori või broomiga halogeene transportivate katalüsaatorite, näiteks FeCl 3, AlCl 3, SnCl 4 ja teiste juuresolekul, asendatakse tsükliliste süsinikuaatomite vesinikuaatomid järjestikku halogeenidega.

Viimases elektrofiilses reaktsioonis Kloor kui esimest tüüpi orienteeriv agens suunab teise klooriaatomi orto- Ja paar- sätted(peamiselt sisse paar-). Erinevalt teistest esimest tüüpi orientantidest aga raskendab reageerimist tugevalt väljendunud elektron-aktseptori omaduste tõttu, laadides tuuma positiivselt. Rünnaku hetkel elektrofiilne osake, algühendi halogeen tagastab osa elektrontihedusest tuuma, luues selle süsinikutele laenguid, mis vastavad esimest tüüpi orientandi toimele (dünaamilise orientatsiooni efekt).
– Alküülasendatud benseenide halogeenimine valguses voolab läbi radikaalne mehhanism ja asendamine toimub kell
α-süsiniku kõrvalahela aatom:

– Nitreerimisel Konovalovi järgi(lämmastikhappe lahjendatud vesilahus, ~140 °C), mis kulgeb radikaalse mehhanismi alusel, viib samuti asenduseni külgmine kett:

– Benseeni ja selle homoloogide oksüdatsioon
Benseeni rõngas oksüdeerub väga raskelt. Kuid V 2 O 5 katalüsaatori juuresolekul temperatuuril 400 °C...500 °C moodustab benseen maleiinhappe:
Benseeni homoloogid oksüdeerimisel annavad aromaatsed happed. Veelgi enam, külgahel annab aromaatse tsükli juures karboksüülrühma, olenemata selle pikkusest.

Oksüdeerivate ainete valimisel on võimalik saavutada külgahelate järjestikune oksüdatsioon.
Katalüsaatorite juuresolekul moodustuvad alküülbenseenidest hüdroperoksiidid, mille lagunemisel tekib fenool ja vastavad ketoonid.

pürotehhiin |
resortsinool |
hüdrokinoon |
|
floroglütsinool |
pürogallool |
||
Fenoolide süstemaatiliseks nimetamiseks kasutatakse IUPAC asendusnomenklatuuri, mille kohaselt peetakse fenoole benseeni hüdroksüülderivaatideks. Seega peaks fenoolil endal, seeria esivanemal, olema range nimetus hüdroksübenseen. Kuid paljudel juhtudel peetakse benseeni derivaate, mis sisaldavad tsüklis hüdroksorühma, fenooli derivaatideks, nagu kajastub nimetus. Näiteks:
C2 H5 |
|||||||
3-etüülfenool |
3-bromo-2,4-dinitrofenool |
||||||
(1-hüdroksü-3-etüülbenseen) |
(1-hüdroksü-3-bromo-2,4-dinitrobenseen) |
||||||
Aromaatsete alkoholide puhul konstrueeritakse asendusnomenklatuurile vastavad nimetused samamoodi nagu alifaatsete alkoholide puhul. Sel juhul on lähtestruktuur alifaatne külgahel, kuna funktsionaalrühm asub seal. Näiteks:
CH2-OH |
CH2-CH-OH |
||||||
fenüülmetanool |
1-fenüülpropaan-2-ool |
||||||
Lisaks saab aromaatsete alkoholide, aga ka alifaatsete alkoholide nimetamiseks kasutada radikaalset funktsionaalset ja ratsionaalset nomenklatuuri. Seega nimetatakse fenüülmetanooli, aromaatsete alkoholide lihtsaimat esindajat, ben-
süülalkohol.

Fenoolid ja aromaatsed alkoholid on struktuursed isomeerid (näiteks kresoolid on isomeersed bensüülalkoholiga). Lisaks võib täheldada teist tüüpi isomeeria, nagu paljude süsivesinike derivaatide puhul.
10.5.2. FENOOLI JA BENSÜÜLALKOHOLI STRUKTUUR
Fenooli molekulis elektri olemus ja suund |
||||||||||
troniefektid on samad, mis halobenseenidel. See |
||||||||||
jah, hüdroksorühma hapnikuaatom interakteerub |
||||||||||
benseeniring läbi –I- ja +M-efektide. |
||||||||||
Kuid (!) fenooli molekulis + M on efekt suurem – I - |
||||||||||
efekt (modulo). Märkimisväärne positiivne mesomeerne efekt on seletatav süsiniku ja hapniku väliste (interakteeruvate) p-orbitaalide geomeetrilise konfiguratsiooni vastavusega, mõlemad aatomid on keemiliste elementide perioodilise tabeli II perioodi aatomid. Selle tulemusena on hüdroksorühma elektrooniline kogumõju benseenitsüklile doonoriefekt.
P-konjugatsiooni tõttu suureneb süsiniku ja hapniku vaheline kaksikühendus: sellel sidemel on 23,7% - iseloom. Samuti peaks fenooli struktuur olema sarnane olematu vinüülalkoholi struktuuriga (ptk 5.1.2, 5.3.1). Kuid erinevalt vinüülalkoholist ei isomeerita fenool oma stabiilse aromaatse süsteemi tõttu.
C-O sideme pikkus fenoolis on lühem kui alkoholides (fenoolis 0,136 nm, metanoolis 0,143 nm) ja selle sideme tugevus on suurem kui alkoholides. Lisaks ilmneb p-konjugatsiooni tõttu hapnikuaatomile elektrontiheduse defitsiit (osaline positiivne laeng), mille tõttu O-H sideme polaarsus suureneb nii palju, et fenoolidel ilmnevad nõrkade hapete omadused.
Hüdroksorühma positiivne mesomeerne toime toob kaasa elektrontiheduse olulise suurenemise benseenitsüklil ja peamiselt o- ja p-positsioonides (ptk 10.1.1). See tingimus vastab mesovalemile

Bensüülalkoholi molekulis ei ole hüdroksorühma hapnikuaatom otseselt seotud aromaatse tsükliga, mistõttu konjugatsioon
nendega võimatu. Hüdroksorühm mõjutab benseeni |
||||||
helisema ainult induktiivse efekti kaudu |
||||||
(–I -efekt), vähendades seeläbi elektronide väärtust |
||||||
sellel pole tihedust. Aga -elektrooniline süsteem ben- |
||||||
tuhatsükkel võib interakteeruda -süsinikuaatomi C-H sidemetega (superkonjugatsioon sarnaneb tolueenis täheldatuga). Seetõttu on aromaatse tsükli elektrontihedus tervikuna võrreldes benseeniga veidi vähenenud, kuid orto- ja eriti para-positsioonid kogevad seda vähenemist vähemal määral. C-O ja O-H sidemete pikkus ja tugevus erinevad vähe alifaatsete alkoholide omadest, kuna benseenitsükli mõju C-O-H fragmendile on väike.
10.5.3. FENOOLIDE FÜÜSIKALISED JA KEEMILISED OMADUSED
Agregatsiooniseisundi järgi on fenoolid värvitud tahked ained või harvem tugeva omapärase lõhnaga vedelikud. Õhus säilitamisel oksüdeeruvad need järk-järgult ja omandavad selle tulemusel värvi roosast kollakaspruunini.
Fenoolid lahustuvad vees halvasti ja nende kõrge keemistemperatuur on tingitud molekulidevahelistest vesiniksidemetest (sarnaselt alkoholidele).
Fenoolide keemilised omadused on määratud hüdroksorühma ja benseenitsükli vastastikuse mõjuga, seetõttu iseloomustavad neid nii benseenitsüklis kui ka hüdroksüülrühmaga seotud reaktsioonid.
10.5.3.1. Happe-aluse omadused
Fenoolide happelised omadused on tugevamad kui alkoholidel (alifaatsed ja aromaatsed). Selle põhjuseks on O-H sideme oluliselt tugevam polarisatsioon, mis on tingitud elektrontiheduse nihkest hapnikuaatomilt benseenitsüklile:
Fenoolide happelised omadused on seletatavad ka fenooli dissotsiatsiooni käigus tekkiva fenolaadiiooni suurema stabiilsusega. Fenolaadi anioonis osaleb aromaatse tsükli elektrooniline süsteem negatiivse laengu delokaliseerimisel:

Fenoolide happelised omadused on aga vähem väljendunud kui karboksüülhapete omad, fenoolide dissotsiatsioon vesilahustes toimub, kuid selle reaktsiooni tasakaal nihkub vasakule. Fenooli ja selle homoloogide pKa väärtus on vahemikus 9,9 kuni 10,4, äädikhappe pKa = 4,76 ja süsihappe pKa = 6,35 (vastavalt dissotsiatsiooni esimesele etapile). See tähendab, et fenool ei interakteeru metallivesinikkarbonaatidega, vaid võib suhelda süsihappe keskmiste sooladega, muutes need happesooladeks, kuna süsihape on dissotsiatsiooni teises etapis nõrgem kui fenool.
OH + NaHCO3
OH + Na2 CO3 ONa + NaHCO3
Fenooli soolad, fenolaadid muundatakse süsihappega suhtlemisel fenooliks:
ONa + H2 CO3 OH + NaHCO3
Elektrone loovutavate või vastuvõtvate asendajate sisestamine fenooli aromaatsesse tsüklisse (eriti o- ja p-positsioonides) vähendab või suurendab vastavalt selle happelisi omadusi. See toime on sarnane asendajate toimega sulfoonhapete aromaatsetel ringidel (peatükk 10.3.3.4). Nii nagu areensulfoonhapetes, suurendavad elektrone eemaldavad asendajad happelisi omadusi aniooni negatiivse laengu täielikuma delokaliseerumise tõttu; elektrone loovutavad asendajad, vastupidi,

vähendada happelisi omadusi, kuna sel juhul takistab nende elektrooniline toime anioonilaengu ümberpaigutamist:
Samadel põhjustel (tänu p-konjugatsioonile, milles osaleb hapnikuelektronide üksik elektronpaar) väheneb fenoolide aluselisus võrreldes alkoholidega oluliselt.
10.5.3.2. Nukleofiilsed omadused
Fenooli molekulis oleva hüdroksüülrühma +M efekti tõttu vähenevad nii aluselised kui ka nukleofiilsed omadused. Seetõttu kulgevad reaktsioonid, milles fenool mängib nukleofiili rolli, vaevaliselt. Leeliseline keskkond aitab kaasa fenooli reaktsioonivõime suurenemisele ja fenooli molekul muundub fenolaadi iooniks. Sellised reaktsioonid on alküülimine ja atsüülimine.
Alküülimine (eetrite moodustumine) . Üldjuhul
Kohalik keskkond soodustab reaktsiooni kulgemist S N 2 mehhanismi kaudu, seetõttu peaks substraate, millel on ligipääsetav kõrge efektiivse positiivse laenguga elektrofiilne reaktsioonikeskus, olema lihtsam alküülida. Sellised substraadid võivad olla primaarsed alküülhalogeniidid ja ennekõike
Metaani derivaadid.
O-CH2-R |
|||
R-CH2Br |
|||
Mõnel juhul kasutatakse dimetüülsulfaati metüüliva ainena, eriti hüdrokinooni, m-kresooli, 4-metüül-2-nitrofenooli jne metüülestrite sünteesil. Näiteks:
OCH3 |
|||||||||
(CH3)2SO4/OH- |
|||||||||
4-metüül-2-nitrofenool |
4-metüül-1-metoksü-2-nitrobenseen |
||||||||
Sama meetodit saab kasutada o- ja p-nitroanisoolide saamiseks o- ja p-nitrofenoolidest.

Atsüülimine (estrite moodustumine) . Tänu vähenenud
Hüdroksüülrühma nukleofiilsuse tõttu võivad fenoole rünnata ainult väga reaktsioonivõimelised atsüülivad ained, nagu karboksüülhapete anhüdriidid ja happehalogeniidid. Reaktsioon viiakse läbi kergelt leeliselises keskkonnas (tavaliselt karbonaatide juuresolekul):
Na2CO3
NaCl
NaHCO3
Atsüülimine salitsüülhape Atseetanhüdriidi kasutatakse ravimi aspiriini tootmiseks:
+ (CH3CO)2O |
||||||||
CH3 COOH |
||||||||
O-C-CH3 |
||||||||
salitsüülhape |
||||||||
(O-atsetüülsalitsüülhape)
Fenoolide esterdamist karboksüülhapete mõjul tavaliselt ei toimu ja see saab võimalikuks ainult tugevate vett eemaldavate ainete (PCl 3, POCl 3, P 2 O 5) juuresolekul. Seda reaktsiooni kasutatakse ravimi salooli tootmisel:
10.5.3.3. Elektrofiilne asendus
Fenoolid, nagu paljud aromaatsed ühendid, on võimelised läbima elektrofiilseid asendusreaktsioone (SE). Pealegi kulgevad fenoolide reaktsioonid elektrofiilsete reagentidega palju kergemini kui benseen ja areenid. See on tingitud suurest +M-efektist, mida hüdroksüülrühm avaldab benseenitsüklile (peatükk 10.1.1). Selle tulemusena suureneb elektronide tihedus rõngal ja seda suurenemist täheldatakse peamiselt o- ja n-positsioonides.
Seetõttu võib fenooli ja elektrofiilse osakese interaktsiooni mehhanismi kujutada järgmiselt:

Oh H |
|||||
Elektrofiili sisenemist benseenitsükli o- ja p-asendisse saab seletada ka tekkivate komplekside stabiilsuse võrdlemisega.
Vaatame mõningaid fenoolide S E reaktsioonide näiteid ja omadusi.
Halogeenimine voolab kergesti. Katalüsaatorit pole vaja. rirovaniye
lõpptooteks võib olla pentaklorofenool. Broomimine toimub tavaliselt lahjendatud vesilahustes.
3 Br2 |
||||||
3 HBr |
||||||
2,4,4,6-tetrabromotsükloheks-2,5-dieen-1-oon

Nitreerimine võib toimuda kas kontsentreeritud või lahjendatud lämmastikhappega. Kontsentreeritud lämmastikhape nitreerib fenooli otse di- ja trinitroderivaatideks, näiteks:
NO2+ |
||
Sel juhul toimub fenooli tugev resiniseerumine.
Fenoolide ja nende estrite molekulides võib toimuda mitte ainult vesinikuaatomi asendamine, vaid ka ruumiliselt ligipääsetavad alküülrühmad:
H3 CCH |
H3 CCH |
|||||||||||||||||||||||||||||||
H3CO |
NO2+ |
H3CO |
||||||||||||||||||||||||||||||
NO2+ |
||||||||||||||||||||||||||||||||
H3 CCH |
CH CH3 |
|||||||||||||||||||||||||||||||
H3CO |
||||||||||||||||||||||||||||||||
H3CO |
||||||||||||||||||||||||||||||||
CH(CH3)2+ |
||||||||||||||||||||||||||||||||
H3 CCH |
||||||||||||||||||||||||||||||||
H3CO |
H3CO |
|||||||||||||||||||||||||||||||
Lahjendatud lämmastikhappe toime fenoolidele toatemperatuuril põhjustab orto- ja paraasendatud mononitrofenoolide moodustumist:

HNO3 + H2O
Arvestades, et nitroonikatioon ei moodustu lahjendatud happes ja seetõttu on nitreerimine elektrofiilse mehhanismi abil võimatu, on sel juhul reaktsioon oksüdatiivne nitrosatsioon (lämmastikhappes sisalduva lämmastikdioksiidi tõttu):
2 EI 2 |
|||||||||||||||||||
HNO3 |
|||||||||||||||||||
HNO2 |
|||||||||||||||||||
HNO3
HNO2
Seetõttu võib mononitreerimise teostamiseks kasutada lahjendatud lämmastikhappe asemel lämmastik- ja lämmastikhappe segu.
Lisaks kasutatakse nitroseerimist ka fenoolide määramiseks ( Liebermani reaktsioon). Fenooli töödeldakse kontsentreeritud väävelhappega ja lisatakse mõni tilk naatriumnitriti vesilahust. Lahjendamisel omandab lahus leelise lisamisel punase värvuse, värvus muutub siniseks. Seda värvireaktsiooni seletatakse indofenooli moodustumisega, mille anioon on sinist värvi:
N-OH2
indofenool (punane värv)
O N O-
Sinine värv
Fenoolide sulfoonimine põhjustab fenoolsulfoonhappeid. Orto- ja para-isomeeride suhe määratakse reaktsiooni temperatuuriga. Ortoisomeer moodustub juba 15 C juures, kuid temperatuuridel 100 C ja üle selle asetub see ümber stabiilsemaks p-isomeeriks.
288 K |
SO3H |
|
H2SO4 |
||
373 K |
||
373 K |
SO3H
Alküleerimine. Lisaks alküülimisele hapnikuaatomi juures, mis toimub leeliselises keskkonnas ja viib lihtsate (alküülarüül)eetrite moodustumiseni, võib reaktsioon toimuda benseenitsüklis. Alküülimine nõuab sel juhul happekatalüsaatorite kasutamist. Alkohole ja alkeene kasutatakse tavaliselt alküülivate ainetena protoonsete hapete (H 2 SO 4, H 3 PO 4) või Lewise hapete (BF 3) juuresolekul:
R+[BF3OH] |
|||||||||
R-OH + BF3 |
|||||||||