Ароматические углеводороды (арены): классификация, номенклатура и изомерия, физические свойства. Органическая химия: Арены Хим свойства арены
А РЕНЫ
Ароматические углеводороды (арены) – циклические углеводороды, объединяемые понятием ароматичности, которая обуславливает общие признаки в строении и химических свойствах.
Классификация
По числу бензольных колец в молекуле арены подразделяются на:
моноядерные
многоядерные

Номенклатура и изомерия
Структурным родоначальником углеводородов бензольного ряда служит бензол С 6 Н 6 от которого строятся систематические названия гомологов.
Для моноциклических соединений сохраняются следующие несистематические (тривиальные) названия:

Положение заместителей указывают наименьшими цифрами (направление нумерации не имеет значения),
|
|
|
а для ди замещенных соединений можно использовать обозначения орто, мета , пара.
|
|
|
|
Если в кольце три заместителя тони должны получить наименьшие номера, т.е. ряд «1,2,4» имеет преимущество перед «1,3,4».


1,2-диметил-4-этилбензол (верное название) 3,4-диметил-1-этилбензол (неверно)
Изомерия монозамещенных аренов обусловлена строением углеродного скелета заместителя, у ди- и полизамещенных гомологов бензола добавляется ещё изомерия, вызванная различным расположением заместителей в ядре.
Изомерия ароматических УВ состава С 9 Н 12:
|
|
|
|
|
Физические свойства
Температуры кипения и плавления у аренов выше, чем у алканов, алкенов, алкинов, малополярные, не растворимы в воде и хорошо растворимы в неполярных органических растворителях. Арены это жидкости или твердые вещества, имеющие специфические запахи. Бензолы и многие конденсированные арены токсичны, некоторые из них проявляют концерогенные свойства. Промежуточными продуктами окисления конденсированных аренов в организме являются эпоксиды, которые либо сами непосредственно вызывают рак, либо являются предшественниками канцерогенов.
Получение аренов
Многие ароматические УВ имеют важное практическое значение и производятся в крупном промышленном масштабе. Ряд промышленных способов основан на переработке угля и нефти.
Нефть состоит главным образом из алифатических и алициклических УВ, для превращения алифатических или ациклических УВ в ароматические разработаны способы ароматизации нефти, химические основы которых развиты Н.Д. Зелинским, Б.А. Казанским.
1. Циклизация и дегидрирование:
2. Гидродезметилирование:

3. Гомологи бензола получают путем алкилирования или ацилирования с последующим восстановлением карбонильной группы.
а) Алкилирование по Фриделю-Крафтсу:

б) Ацилирование по Фриделю-Крафтсу:

4. Получение бифенила по реакции Вюрца-Фитинга:
5. Получение дифенилметана по реакции Фриделя-Крафтса:
Строение и химические свойства.
Критерии ароматичности:
На основании теоретических расчетов и экспериментального изучения циклических сопряженных систем было установлено, что соединение ароматично, если оно имеет:
- Плоский циклический σ-скелет;
- Сопряженную замкнутую π-электронную систему, охватывающую все атомы цикла и содержащую 4n + 2, где n = 0, 1, 2, 3 и т.д. Эта формулировка известна, как правило Хюккеля. Критерии ароматичности позволяют отличать сопряженные ароматические системы от всех других. Бензол содержит секстет π-электронов и соответствует правилу Хюккеля при n = 1.

Что дает ароматичность:
Несмотря на высокую степень ненасыщенности, ароматические соединения устойчивы к действию окислителей и температуры, они более склонны вступать в реакции замещения, а не присоединения. Эти соединения обладают повышенной термодинамической стабильностью, обеспечивающейся высокой энергией сопряжения ароматической системы кольца (150 кДж/моль), поэтому арены предпочтительней вступают в реакции замещения, в результате чего сохраняют ароматичность.
Механизм реакций электрофильного замещения в ароматическом кольце:
Электронная плотность π-сопряженной системы бензольного кольца является удобным объектом для атаки электрофильными реагентами.
Как правило, электрофильные реагенты генерируются в процессе реакции при помощи катализаторов и соответствующих условий.
Е – Y → E δ + – Y δ - → E + + Y -
Образование π-комплекса. Первоначальная атака электрофилом π-электронного облака кольца приводит к координации реагента с π-системой и образованию комплекса донорно-акцепторного типа называемого π-комплекса. Ароматическая система не нарушается:

Образование σ-комплекса. Лимитирующая стадия, на ней электрофил образует ковалентную связь с атомом углерода за счет двух электронов π-системы кольца, что сопровождается переходом данного атома углерода из sp 2 - в sp 3 - гибридное состояние и нарушением ароматической, молекула превращается в карбокатион.

Стабилизация σ-комплекса. Осуществляется путем отщепления от σ-комплекса протона с помощью основания. При этом за счет двух электронов разрывающейся ковалентной связи С – Н восстанавливается замкнутая π-системы кольца, т.е. происходит возврат молекулы в ароматическое состояние:

Влияние заместителей на реакционную способность и ориентацию электрофильного замещения
Заместители в бензольном кольце нарушают равномерность в распределении π- электронного облака кольца и тем самым оказывают влияние на реакционную способность кольца.
- Электронодонорные заместители (Д) повышают электронную плотность кольца и увеличивают скорость электрофильного замещения, такие заместители называют активирующими.
- Электроноакцепторные заместители (А) понижают электронную плотность кольца и уменьшают скорость реакции, называются дезактивирующими.
АРЕНЫ (ароматические углеводороды)
Арены или ароматические углеводороды – это соединения, молекулы которых содержат устойчивые циклические группы атомов (бензольные ядра) с замкнутой системой сопряженных связей.
Почему "Ароматические"? Т.к. некоторые из ряда веществ имеют приятный запах. Однако в настоящее время в понятие "ароматичность" вкладывается совершенно иной смысл.
Ароматичность молекулы означает ее повышенную устойчивость, обусловленную делокализацией π-электронов в циклической системе.
Критерии ароматичности аренов:
- Атомы углерода в sp 2 -гибридизованном состоянии образуют цикл.
- Атомы углерода располагаются в одной плоскости (цикл имеет плоское строение).
Замкнутая система сопряженных связей содержит
4n+2 π-электронов (n – целое число).
Этим критериям полностью соответствует молекула бензола С 6 Н 6 .
Понятие “бензольное кольцо ” требует расшифровки. Для этого необходимо рассмотреть строение молекулы бензола.
В
се связи между атомами углерода в бензоле одинаковые (нет как таковых двойных и одинарных) и имеют длину 0,139нм. Эта величина является промежуточной между длиной одинарной связи в алканах (0,154нм) и длиной двойной связи в алкенах (0,133 им).Равноценность связей принято изображать кружком внутри цикла
Круговое сопряжение дает выигрыш в энергии 150 кДж/моль. Эта величина составляет энергию сопряжения — количество энергии, которое нужно затратить, чтобы нарушить ароматическую систему бензола.
Общая фоормула: C n H 2n-6 (n ≥ 6)
Гомологический ряд:
Гомологи бензола – соединения, образованные заменой одного или нескольких атомов водорода в молекуле бензола на углеводородные радикалы (R):
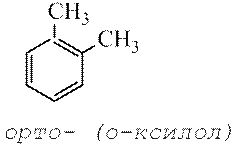
орто
- (о
-)
заместители у соседних атомов углерода кольца, т.е. 1,2-;
мета
- (м
-)
заместители через один атом углерода (1,3-);
пара
- (п
-)
заместители на противоположных сторонах кольца (1,4-).
арил
C 6 H 5 - (фенил ) и C 6 H
Ароматические одновалентные радикалы имеют общее название "арил ". Из них наиболее распространены в номенклатуре органических соединений два:C 6 H 5 - (фенил ) и C 6 H 5 CH 2 - (бензил ). 5 CH 2 - (бензил ).
Изомерия:
структурная:
1) положения заместителей для ди -, три - и тетра -замещенных бензолов (например, о -, м - и п -ксилолы);
2) углеродного скелета в боковой цепи, содержащей не менее 3-х атомов углерода:
3) изомерия заместителей R, начиная с R = С 2 Н 5 .
Химические свойства:
Для аренов более характерны реакции, идущие с сохранением ароматической системы , а именно, реакции замещения атомов водорода, связанных с циклом.
2. Нитрование
Бензол реагирует с нитрующей смесью (смесью концентрированныхазотной и серной кислот):
3. Алкилирование
Замещение атома водорода в бензольном кольце на алкильную группу(алкилирование ) происходит под действием алкилгалогенидов или алкенов в присутствии катализаторов AlCl 3 , AlBr 3 , FeCl 3 .
Замещение в алкилбензолах:
Гомологи бензола (алкилбензолы) более активно вступают в реакции замещения по сравнению с бензолом.
Например, при нитровании толуола С 6 Н 5 CH 3 может происходить замещение не одного, а трех атомов водорода с образованием 2,4,6-тринитротолуола:
и облегчает замещение именно в этих положениях.С другой стороны, под влиянием бензольного кольца метильная группа СH 3 в толуоле становится более активной в реакциях окисления и радикального замещения по сравнению с метаном СH 4 .
Толуол, в отличие от метана, окисляется в мягких условиях (обесцвечивает подкисленный раствор KMnO 4 при нагревании):
Легче, чем в алканах, протекают реакции радикального замещения в боковой цепи алкилбензолов:
Это объясняется тем, что на лимитирующей стадии легко (при невысокой энергии активации) образуются устойчивые промежуточные радикалы. Например, в случае толуола образуется радикал бензил Ċ H 2 -C 6 H 5 . Он более стабилен, чем алкильные свободные радикалы (Ċ Н 3 , Ċ H 2 R), т.к. его неспаренный электрон делокализован за счет взаимодействия с π-электронной системой бензольного кольца:
Правила ориентации
- Заместители, имеющиеся в бензольном ядре, направляют вновь вступающую группу в определенные положения, т.е. оказывают ориентирующее действие.
По своему направляющему действию все заместители делятся на две группы: ориентанты первого рода и ориентанты второго рода .
Ориентанты 1-го рода (орто-пара -ориентанты) направляют последующее замещение преимущественно в орто - и пара -положения.
К ним относятся электронодонорные группы (электронные эффекты групп указаны в скобках):
R (+I ); - OH (+M,-I ); - OR (+M,-I ); - NH 2 (+M,-I ); - NR 2 (+M,-I ) +M-эффект в этих группах сильнее, чем -I-эффект.
Ориентанты 1-го рода повышают электронную плотность в бензольном кольце, особенно на углеродных атомах в орто - и пара -положениях, что благоприятствует взаимодействию с электрофильными реагентами именно этих атомов.Ориентанты 1-го рода, повышая электронную плотность в бензольном кольце, увеличивают его активность в реакциях электрофильного замещения по сравнению с незамещенным бензолом.
Особое место среди ориентантов 1-го рода занимают галогены, проявляющие электроноакцепторные свойства:
-F (+M<–I ), -Cl (+M<–I ), -Br (+M<–I ).
Являясь орто-пара
-ориентантами, они замедляют электрофильное замещение. Причина - сильный –I
-эффект электроотрицательных атомов галогенов, понижащий электронную плотность в кольце.
Ориентанты 2-го рода (мета
-ориентанты)
направляют последующее замещение преимущественно в мета
-положение.
К ним относятся электроноакцепторные
группы:
-NO 2 (–M, –I ); -COOH (–M, –I ); -CH=O (–M, –I ); -SO 3 H (–I ); -NH 3 + (–I ); -CCl 3 (–I ).
Ориентанты 2-го рода уменьшают электронную плотность в бензольном кольце, особенно в орто
- и пара
-положениях. Поэтому электрофил атакует атомы углерода не в этих положениях, а в мета
-положении, где электронная плотность несколько выше.
Пример:
Таким образом, легкость электрофильного замещения для соединений (приведенных в качестве примеров) уменьшается в ряду:
толуол C 6 H 5 CH В отличие от бензола его гомологи окисляются довольно легко.1. Классификация ароматических углеводородов.
2. Гомологический ряд моноциклических аренов, номенклатура, получение.
3. Изомерия, строение бензола и его гомологов.
4. Свойства аренов.
Аренами называют богатые углеродом циклические углеводороды, которые содержат в молекуле бензольное ядро и обладают особыми физическими и химическими свойствами. Арены по числу бензольных колец в молекуле и способа соединения циклов подразделяют на моноциклические (бензол и его гомологи) и полициклические (с конденсированными и изолированными циклами) соединения.
Арены бензольного ряда можно рассматривать как продукты замещения атомов водорода в молекуле бензола на алкильные радикалы. Общая формула таких аренов СnH 2 n- 6. В названии монозамещенных аренов указывают название радикала и цикла (бензол):
бензол метилбензол (толуол) этилбензол.
В более замещенных аренах положение радикалов указывают наименьшими цифрами, в дизамещенных аренах положение радикалов называют: 1,2 - орто (o -)-, 1,3 - мета (м -)- и 1,4 - пара (п -)-:

1,3-диметилбензол 1,2-метилэтилбензол
м -диметилбензол (м -ксилол) о -метилэтилбензол (о -ксилол)
Для аренов широко распространены тривиальные названия (некоторые названия указаны в скобках).
Нахождение в природе.
Ароматические углеводороды встречаются в растительных смолах и бальзамах. Фенантрен в частично или полностью гидрированном виде содержится в структурах многих природных соединений, например стероидов, алкалоидов.
Получение аренов:
1. сухая перегонка каменного угля;
2. дегидрирование циклоалканов

3. дегидроциклизация алканов с 6 и более атомами углерода в составе
4. алкилирование

![]()
Изомерия. Для гомологов бензола характерна структурная изомерия: различное строение углеродного скелета бокового радикала и различные состав и расположение радикалов в бензольном кольце. Например, изомеры ароматических углеводородов состава С 9 Н 12 (пропилбензол, изопропилбензол, о-метилэтилбензол и 1,2,4-триметилбензол):
Строение. Ароматические углеводороды имеют целый ряд особенностей в электронном строении молекул.
Структурную формулу бензола впервые предложил А. Кекуле. Это шестичленный цикл с чередующимися двойными и одинарными связями, при этом двойные связи перемещаются в структуре:
В обеих формулах углерод четырехвалентен, все атомы углерода равноценны и дизамещенные бензола существуют в виде трех изомеров (орто -, мета -, пара- ). Однако такая структура бензола противоречила его свойствам: бензол не вступал в характерные для непредельных углеводородов реакции присоединения (например, брома) и окисления (например, с перманганатом калия), для него и его гомологов основной тип химического превращения - реакции замещения.
Современный подход к описанию электронного строения бензола разрешает это противоречие следующим образом. Атомы углерода в молекуле бензола находятся в sр 2 -гибридизации. Каждый из атомов углерода образует три ковалентные σ-связи - 2 связи с соседними атомами углерода (sр 2 -sр 2 -перекрывание орбиталей) и одну с атомом водорода (sр 2 -s- перекрывание орбиталей). Негибридизованные р-орбитали за счет бокового перекрывания образуют π-электронную сопряженную систему (π,π-сопряжение), содержащую шесть электронов. Бензол представляет собой плоский правильный шестиугольник с длиной связи углерод-углерод 0,14нм, связи углерод-водород 0,11нм, валентными углами 120 0:

Молекула бензола стабильнее циклических соединений с изолированными двойными связями, поэтому бензол и его гомологи склонны к реакциям замещения (бензольное кольцо сохраняется), а не присоединения и окисления.
Сходство в строении и свойствах (ароматичность) с бензолом проявляют и другие циклические соединения. Критерии ароматичности (Э. Хюккель, 1931г.):
а) плоская циклическая структура, т.е. атомы, образующие цикл, находятся в sр 2 -гибридизации; б) сопряженная электронная система; в) число электронов (N) в кольце равно 4n+2, где n - любое целочисленное значение - 0,1,2,3 и т.д.
Критерии ароматичности применимы как к нейтральным, так и заряженным циклическим сопряженным соединениям, поэтому ароматическими соединениями будут, например:
фуран катион циклопропенила.
Для бензола и других ароматических соединений наиболее характерны реакции замещения атомов водорода при углеродных атомах в цикле и менее характерны реакции присоединения по π-связи в цикле.
Физические свойства.
Бензол и его гомологи являются бесцветными жидкостями и кристаллическими веществами со своеобразным запахом. Они легче воды и плохо в ней растворяются. Бензол неполярное соединение(μ=0), алкилбензолы -
полярные соединения(μ≠0).
Химические свойства.
Электрофильное замещение. Наиболее характерным превращением для аренов является электрофильное замещение - S Е. Реакция протекает в две стадии с образованием промежуточного σ-комплекса:
Условиях реакции: температура 60-80 0 С, катализаторы - кислоты Льюса или минеральные кислоты.
Типичные S Е - реакции:
а) галогенирование (Cl 2 , Br 2):
б) нитрование:
в ) сульфирование (H 2 SO 4 , SO 3 , олеум):
г) алкилирование по Фриделю-Крафтсу (1877г.) (RНal, ROH, алкены):
д) алкилирование по Фриделю-Крафтсу (галогенангидриды, ангидриды карбоновых кислот):
У гомологов бензола в результате влияния бокового радикала (+I-эффект, электронодонорная группа) π-электронная плотность бензольного кольца распределена неравномерно, увеличиваясь в 2,4,6-положениях. Поэтому S Е -реакции протекают направлено (в 2,4,6- или о- и п- положения). Гомологи бензола по сравнению с бензолом в реакциях этого типа проявляют большую реакционная активность.
толуол п -хлортолуол о -хлортолуол
Реакции боковых радикалов в алкилбензолах (радикальное замещение - S R и окисление).
Реакции радикального замещения протекают, как и в предельных углеводородах, по цепному механизму и включают стадии инициирования, роста и обрыва цепи. Реакция хлорирования протекает ненаправлено, реакция бромирования региоселективна - замещение водорода происходит уα-углеродного атома.
В алкилбензолах боковая цепь окисляется перманганатом калия, бихроматом калия с образованием карбоновых кислот. Независимо от длины боковой цепи, окисляется атом углерода, связанный с бензольным ядром (α-углеродный или бензильный атом углерода), остальные атомы углерода окисляются до СО 2 или карбоновых кислот.
этилбензол бензойная кислота
п -метилэтилбензол терефталевая кислота
Реакции бензола с нарушением ароматической системы.
Ароматические углеводороды имеют прочный цикл, поэтому реакции с нарушением ароматической системы (окисление, радикальное присоединение) протекают в жестких условиях (высокие температуры, сильные окислители).
а) радикальное присоединение:
1. гидрирование
![]()
толуол циклогексан
2. хлорирование

бензол 1,2,3,4,5,6-гексахлорциклогексан (гексахлоран).
Продукт этой реакции представляет смесь пространственных изомеров.
Ориентация электрофильного замещения в ароматических соединениях. Заместители в бензольном кольце по своему ориентирующему влиянию делятся на два типа: орто -, пара -ориентанты (заместители 1 рода) и мета -ориентанты (заместители 2 рода).
Заместители 1 рода - это электронодонорные группы, которые повышают электронную плотность кольца, увеличивают скорость реакции электрофильного замещения и активируют бензольное кольцо в этих реакциях:
D(+I-эффект): - R, -СН 2 ОН, -СН 2 NН 2 и т.д.
D(-I,+М-эффекты): -NH 2 ,-OH, -OR, -NR 2 , -SH и т.д.
Заместители 2 рода – электроноакцепторные группы, которые понижают электронную плотность кольца, уменьшают скорость реакции электрофильного замещения и дезактивируют бензольное кольцо в этих реакциях:
А (-I-эффект): -SO 3 H, -CF 3 , -CСl 3 и т.д.
А (-I, -М -эффект): -НС=О, -СООН, -NO 2 и т. д.
Атомы галогенов занимают промежуточное положение - они понижают электронную плотность кольца, уменьшают скорость реакции электрофильного замещения и дезактивируют бензольное кольцо в этих реакциях, однако это о -,п -ориентанты.
Если в бензольном кольце находится два заместителя, то их ориентирующее действие может совпадать (согласованная ориентация ) или не совпадать (несогласованная ориентация ). В реакциях электрофильного замещения соединения с согласованной ориентацией образуют меньшее количество изомеров, во втором случае образуется смесь из большего числа изомеров. Например:
 п
-
гидроксибензойная
кислота м
-
гидроксибензойная
кислота
п
-
гидроксибензойная
кислота м
-
гидроксибензойная
кислота
(согласованная ориентация) (несогласованная ориентация)
Полициклические конденсированные ароматические углеводороды (нафталин, антрацен, фенантрен и т.д.), в основном, по свойствам похожи на бензол, но вместе с тем имеют некоторые отличия.
Применение:
1. ароматические углеводороды - сырье для синтеза красителей, взрывчатых веществ, лекарственных препаратов, полимеров, поверхностно-активных веществ, карбоновых кислот, аминов;
2. жидкие ароматические углеводороды хорошие растворители органических соединений;
3. арены - добавки для получения высокооктановых бензинов.
Знаете ли вы, что -В 1649 году немецкий химик Иоганн Глаубер впервые получил бензол.
В 1825 году М. Фарадей выделил из светильного газа углеводород и установил его состав - С 6 Н 6 .
В 1830 году Юстус Либих назвал полученное соединение бензолом (от араб. Вen-аромат + zoa-сок + лат. ol-масло).
В1837 году Огюстом Лораном назван радикал бензола С 6 Н 5 - фенил (от греч phenix-освещать).
В 1865 году немецкий химик-органик Фридрих Август Кекуле предложил формулу бензола с чередующимися двойными и одинарными связями в шестичленном цикле.
В 1865-70-х годах В. Кернер предложил использовать приставки для обозначения взаимного расположения двух заместителей: 1,2 положение - орто- (orthos - прямой);1,3- мета (meta - после) и 1,4- пара (para - напротив).
Ароматические углеводороды - высокотоксичные вещества, вызывают отравление и поражение некоторых органов, например почек, печени.
Некоторые ароматические углеводороды - канцерогены (вещества, вызывающие раковые заболевания), например бензол (вызывает лейкемию), один из сильнейших - бензопирен (содержится в табачном дыме).
Ароматические химические соединения, или арены, представляют собой большую группу карбоциклических соединений, в молекулах которых содержится устойчивый цикл из шести углеродных атомов. Она носит название «бензольное кольцо» и обуславливает особые физические и химические свойства аренов.
К ароматическим углеводородам относится в первую очередь бензол и всевозможные его гомологи и производные.
В молекулах аренов может содержаться несколько бензольных колец. Такие соединения называют многоядерными ароматическими соединениями. Например, нафталин - всем известный препарат для защиты шерстяных изделий от моли.
Бензол
Этот простейший представитель аренов состоит только из бензольного кольца. Его молекулярная формула С 6 Η 6 . Структурную формулу молекулы бензола чаще всего представляют циклической формой, предложенной А. Кекуле в 1865 году.
Достоинством этой формулы является верное отражение состава и равноценности всех атомов С и Н в кольце. Однако она не могла объяснить многих химических свойств аренов, поэтому утверждение о наличии трех сопряженных двойных связей С=С является ошибочным. Это стало известно лишь с появлением современной теории связей.
Между тем и сегодня часто встречается написание формулы бензола способом, предложенным Кекуле. Во-первых, с ее помощью удобно записывать уравнения химических реакций. Во-вторых, современные химики видят в ней лишь символ, а не реальную структуру. Строение молекулы бензола сегодня передают различными типами структурных формул.
Строение бензольного кольца
Главной особенностью бензольного ядра можно назвать отсутствие в нем одинарных и двойных связей в традиционном понимании. В соответствии с современными представлениями молекула бензола представляется плоским шестиугольником с длинами сторон равными 0,140 нм. Получается, что длина связи С-С в бензоле является промежуточным значением между одинарной (ее длина 0,154 нм) и двойной (0,134 нм). В той же плоскости лежат и связи С-Н, образующие с ребрами шестиугольника угол в 120°.
Каждый атом С в структуре бензола находится в sp2-гибридном состоянии. Он соединен посредством трех своих гибридных орбиталей с двумя атомами С, расположенными по соседству, и одним атомом Н. То есть образует три s-связи. Еще одна, но уже негибридизованная его 2р-орбиталь, перекрывается с такими же орбиталями соседних атомов С (справа и слева). Ось ее перпендикулярна плоскости кольца, а значит перекрывание орбиталей происходит над и под ней. При этом образуется общая замкнутая π-электронная система. Из-за равнозначного перекрывания 2р-орбиталей шести атомов С происходит своего рода «уравнивание» связей С-С и С=С.
Результатом этого процесса является сходство таких «полуторных» связей и с двойными, и с одинарными. Этим объясняется тот факт, что проявляют арены химические свойства, характерные и для алканов, и для алкенов.
Энергия углерод-углеродной связи в бензольном кольце равняется 490 кДж/моль. Что также является также средней величиной между энергиями простой и кратной двойной связи.

Номенклатура аренов
Основой названий ароматических углеводородов является бензол. Атомы в кольце нумеруют со старшего заместителя. Если же заместители равнозначны, то нумерацию осуществляют по кратчайшему пути.
Для многих гомологов бензола часто используют тривиальные названия: стирол, толуол, ксилол и т. д. Для отражения взаимного расположения заместителей принято использовать приставки οртο-, мета-, пара-.
Если в молекуле имеются функциональные группы, например, карбонильная или карбоксильная, то молекулу арена рассматривают как соединенный с ней ароматический радикал. Например, -С 6 Η 5 - фенил, -C 6 Η 4 - фенилен, С 6 Η 5 —СΗ 2 — - бензил.
Физические свойства
Первые представители в гомологическом ряду бензола - это бесцветные жидкости, имеющие специфичес-кий запах. Их вес легче воды, в которой они практически не растворяются, но хорошо растворяются в большинстве органических растворителей.
Все ароматические углеводороды горят с появлением коптящего пламени, что объясняется высоким содержанием С в молекулах. Температуры плавления и кипения их повышаются с увеличением значений молекулярных масс в гомологическом ряду бензола.
Химические свойства бензола
Из разнообразных химических свойств аренов реакции замещения следует упомянуть отдельно. Также весьма значимы некоторые реакции присоединения, осуществляющиеся в особых условиях, и процессы окисления.
Реакции замещения
Довольно подвижные π-электроны бензольного кольца, способны очень активно реагировать с атакующими электрофилами. В таком электрофильном замещении участвует само бензольное ядро в бензоле и связанная с ним углеводородная цепь в его гомологах. Механизм этого процесса довольно подробно изучен органической химией. Химические свойства аренов, связанные с атакой электрофилов, проявляются посредством трех стадий.
- Первая стадия. Появление π-комплекса из-за связывания π-электронной системы бензольного ядра с частицей Х + , которая связывается с шестью π-электронами.

Бромирование бензола в присутствии бромидов железа или алюминия без нагревания приводит к получению бромбензола:
C 6 Η 6 + Br 2 —> C 6 Η 5 -Br + ΗBr.
Нитрование смесью азотной и серной кислот приводит к получению соединений с нитрогруппой в кольце:
C 6 Η 6 + ΗONO 2 —> C 6 Η 5 —NO 2 + Η 2 O.
Сульфирование осуществляется бисульфониевым ионом, образующимся в результате реакции:
3Η 2 SO 4 ⇄ SO 3 Η + + Η 3 O + + 2ΗSO 4 - ,
или триоксид серы.
Соответствует данному химическому свойству аренов реакция:
C 6 H 6 + SO 3 H + —> C 6 H 5 —SO 3 H + H + .
Реакции алкильного и ацильного замещения, или реакции Фриделя-Крафтса, проводят в присутствии безводного AlCl 3 .

Эти реакции маловероятны для бензола и протекают с трудом. Присоединение галогеноводородов и воды к бензолу не происходит. Однако при очень высоких температурах в присутствии платины возможна реакция гидрирования:
С 6 Η 6 + 3Н 2 —> С 6 Н 12 .
При облучении ультрафиолетом к молекуле бензола могут присоединиться молекулы хлора:
С 6 Η 6 + 3Cl 2 —> C 6 Η 6 Cl 6 .
Реакции окисления
Бензол весьма устойчив к окислителям. Так, он не обесцвечивает розовый раствор перманганата калия. Однако в присутствии оксида ванадия он может окисляться кислородом воздуха до малеиновой кислоты:
С 6 Н 6 + 4О —> СООΗ-СΗ=СΗ-СООΗ.
На воздухе бензол горит с появлением копоти:
2C 6 Η 6 + 3O2 → 12C + 6Η 2 O.
Химические свойства аренов
- Замещение.


Правила ориентации
Какое именно положение (о-, м- или п-) займет заместитель в ходе взаимодействия электрофильного агента с бензольным кольцом определяется правилами:
- если в бензольном ядре уже имеется какой-либо заместитель, то именно он направляет входящую группу в определенное положение;
- все ориентирующие заместители делят на две группы: ориентанты первого рода направляют поступающую группу атомов в орто- и пара-положения (—NΗ 2 , —ОΗ,—СΗ 3 , —С 2 Н 5 , галогены); ориентанты второго рода направляют вступающие заместители в мета-положение (—NO 2 , —SO 3 Η, —СΗО, —СООΗ).
Ориентанты здесь указаны в порядке уменьшения направляющей силы.
Стоит отметить, что такое разделение заместителей группы является условным, из-за того, в большинстве реакций наблюдается образование всех трех изомеров. Ориентанты же влияют лишь на то, какой из изомеров будет получен в большем количестве.
Получение аренов
Основными источниками аренов являются сухая перегонка каменного угля и нефтепереработка. В каменноугольной смоле содержится огромное количество всевозможных ароматических углеводородов. В некоторых сортах нефти содержится до 60% аренов, которые несложно выделить простой перегонкой, пиролизом или крекингом.
Способы синтетического получения и химические свойства аренов зачастую бывают взаимосвязаны. Бензол, как и его гомологи, получают одним из следующих способов.
1. Риформинг нефтепродуктов. Дегидрирование алканов - важнейший промышленный способ синтеза бензола и многих его гомологов. Реакцию ведут при пропускании газов над нагретым катализатором (Pt, Cr 2 O 3 , оксиды Mo и V) при t = 350-450 о С:
С 6 Н 14 —> С 6 Η 6 + 4Η 2 .
2. Реакция Вюрца-Фиттига. Она осуществляется через стадию получения металлорганических соединений. В итоге реакции возможно получение нескольких продуктов.
3. Тримеризация ацетилена. Сам ацетилен, как и его гомологи способны образовывать арены при нагревании с катализатором:
3С 2 Η 2 —> С 6 Η 6 .
4. Реакция Фриделя-Крафтса. Выше уже был рассмотрен в химических свойствах аренов способ получения и превращения гомологов бензола.
5. Получение из соответствующих солей. Бензол можно выделить при перегонке солей бензойной кислоты со щелочью:
C 6 Η 5 —COONa + NaOΗ —> C 6 Η 6 + Na 2 CO 3 .
6. Восстановлением кетонов:
C 6 Η 5 -CO-CΗ 3 + Zn + 2ΗCl —> C 6 Η 5 -CΗ 2 -CΗ 3 + Η 2 O + ZnCl 2 ;
CΗ 3 -C 6 Η 5 -CO-CΗ 3 + NΗ 2 -NΗ 2 —> CΗ 3 -C 6 Η 5 -CΗ 2 -CΗ 3 + Η 2 O.
Применение аренов
Химические свойства и области применения аренов имеют прямую взаимосвязь, поскольку основная часть ароматических соединений идет для дальнейшего синтеза в химическом производстве, а не используется в готовом виде. Исключение составляют вещества, применяемые в качестве растворителей.
Бензол С 6 Η 6 применяется по большей части в синтезе этилбензола, кумола и циклогексана. На его основе получают полупродукты для изготовления различных полимеров: каучуков, пластмасс, волокон, красителей, ПАВ, инсектицидов, лекарств.

Толуол С 6 Н 5 -СН 3 используют при производстве красителей, лекарств и взрывчатых веществ.
Ксилолы С 6 Η 4 (СΗ 3) 2 в смешанном виде (технический ксилол) применяются в качестве растворителя или исходного препарата для синтеза органических веществ.
Изопропилбензол (или кумол) С 6 Η 4 -СΗ(СΗ 3) 2 является исходным реагентом для синтеза фенола и ацетона.
Винилбензол (стирол) C 6 Η 5 -CΗ=СΗ 2 является сырьем для получения важнейшего полимерного материала - полистирола.
Арены (ароматические углеводороды) - соединения, в молекулах которых содержится одно или несколько бензольных колей - циклических групп атомов углерода со специфическим характером связей.
Бензол - молекулярная формула С 6 Н 6 . Впервые была предложена А. Кекуле:
Строение аренов.
Все 6 атомов углерода находятся в sp 2 -гибридизации . Каждый атом углерода образует 2 σ -связи с двумя соседними атомами углерода и одним атомом водорода, которые находятся в одной плоскости. Углы составляют 120°. Т.е. все атомы углерода лежат в одной плоскости и образуют шестигранник. У каждого атома есть негибридная р -обиталь, на которой находится неспаренный электрон. Эта орбиталь перпендикулярна плоскости, и поэтому π -электронное облако «размазано» по всем атомам углерода:

Все связи равноценны. Энергия сопряжения - количество энергии, которую надо затратить, чтобы разрушить ароматическую систему.
Именно это обуславливает специфические свойства бензола - проявление ароматичности. Это явление было открыто Хюккелем, и называется правилом Хюккеля.
Изомерия аренов.
Арены можно разделить на 2 группы:
- производные бензола:

- конденсированные арены:

Общая формула аренов - С n H 2 n -6 .
Для аренов характерна структурная изомерия, которая объясняется взаимным расположением заместителей в кольце. Если в кольце находится 2 заместителя, то они могут находиться в 3-х различных положениях - орто (о-), мета (м-), пара (п-):

Если от бензола «отобрать» один протон, то образуется радикал - C 6 H 5 , которое носит название арильного радикала. Простейшие:

Называют арены словом «бензол» с указанием заместителей в кольце и их положения:

Физические свойства аренов.
Первые члены ряда - жидкости без цвета с характерным запахом. Они хорошо растворяются в органических растворителях, но нерастворимы в воде. Бензол токсичен, но имеет приятный запах. Вызывает головную боль и головокружения, при вдыхании больших количеств паров можно потерять сознание. Раздражает слизистую оболочку и глаза.
Получение аренов.
1. Из алифатических углеводородов с помощью «ароматизации» предельных углеводородов, входящих в состав нефти. При пропускании над платиной или оксидом хрома наблюдается дигидроциклизация:

2. Дегидрирование циклоалканов:

3. Из ацетилена (тримеризация) при пропускании над раскаленным углем при 600°С:

4. Реакция Фриделя - Крафтса в присутствии хлорида алюминия :

5. Сплавление солей ароматических кислот с щелочью:
Химические свойства аренов.
Реакции замещения аренов.
Ядро аренов обладает подвижной π -системой, на которую действуют электрофильные реагенты. Для аренов характерно электрофильное замещение, которое можно представить так:

Электрофильная частица притягивается к π -системе кольца, затем образуется прочная связь между реагентом Х и одним из атомов углерода, при этом единство кольца нарушается. Для восстановления ароматичности выбрасывается протон, а 2 электрона С-Н переходят в π-систему кольца.
1. Галогенирование происходит в присутствии катализаторов - безводных хлоридов и бромидов алюминия , железа :

2. Нитрование аренов. Бензол очень медленно реагирует с концентрированной азотной кислотой при сильном нагревании. Но если добавить серную кислоту , то реакция протекает очень легко:
3. Сульфирование протекает под воздействием 100% - серной кислоты - олеума:
4. Алкилирование алкенами . В результате происходит удлинение цепи, реакция протекает в присутствии катализатора - хлорида алюминия.