Formula pentru disocierea apei. Disocierea apei. Produsul ionic al apei pH-ul și pH-ul soluțiilor. Indicator de hidrogen - pH
Apa pură, deși săracă (în comparație cu soluțiile de electroliți), poate conduce curent electric. Acest lucru este cauzat de capacitatea unei molecule de apă de a se dezintegra (disocia) în doi ioni, care sunt conductori de curent electric în apa pură (mai jos, disocierea înseamnă disociere electrolitică - dezintegrare în ioni):
H 2 O ↔ H + + OH -
Pentru aproximativ 556.000.000 de molecule de apă nedisociate, doar 1 moleculă se disociază, dar aceasta este 60.000.000.000 de molecule disociate în 1 mm3. Disocierea este reversibilă, adică ionii H + și OH - pot forma din nou o moleculă de apă. Până la urmă vine dinamic echilibru în care numărul de molecule degradate este egal cu numărul de ioni H + și OH - formați. Cu alte cuvinte, vitezele ambelor procese vor fi egale. Pentru cazul nostru, ecuația vitezei reacție chimică il poti scrie asa:
υ 1 = κ 1 (pentru disocierea apei)
υ 2 = κ 2 (pentru procesul invers)
Unde υ - viteza de reactie; κ - constanta vitezei de reacție (în funcție de natura reactanților și temperatură); , Şi - concentratie (mol/l).
Într-o stare de echilibru υ 1 = υ 2, prin urmare:
κ 1 = κ 2
Să facem niște calcule simple și să obținem:
κ 1 /κ 2 = /
κ 1 / κ 2 = K
K- constantă de echilibru, iar în cazul nostru, constantă de disociere, care depinde de temperatura și natura substanțelor, și nu depinde de concentrații (precum și κ 1 și κ 2). K pentru apa 1,8 10 -16 la 25 °C (valoare de referinta).
Datorită numărului foarte mic de molecule disociate, concentrația poate fi considerată egală cu concentrația totală de apă, iar concentrația totală de apă în soluții diluate ca valoare constantă: =1000(g/l)/18(g/mol)=55,6 mol/l.
Înlocuirea κ 1 / κ 2 pe Kși folosind valoarea , determinăm cu ce este egal produsul concentrațiilor Şi care se numește - produs ionic al apei:
K = /55,6 mol/l
1,8 10 -16 55,6 mol/l =
10 -14 =
Deoarece, la o anumită temperatură, cantitățile utilizate la calcularea produsului ionic al apei ( K, ) sunt constante, valoarea produsului ionic al apei la fel tot timpul. Și din moment ce disocierea unei molecule de apă produce același număr de ioni Şi , rezultă că pentru apă pură concentrația Şi va fi egal 10 -7 mol/l. Din constanța produsului ionic al apei, rezultă că, dacă numărul de ioni H + devine mai mare, atunci numărul de ioni HO - devine mai mic. De exemplu, dacă se adaugă un acid HCl puternic la apa pură, acesta, ca electrolit puternic, se va disocia complet în H + și Cl -, ca urmare, concentrația de ioni de H + va crește brusc și acest lucru va duce la o creștere a vitezei procesului opus disocierii, deoarece depinde de concentrația ionilor H+ și OH-:
υ 2 = κ 2
În timpul procesului accelerat opus disocierii, concentrația ionilor HO - va scădea la o valoare corespunzătoare noului echilibru, la care vor fi atât de puțini, încât ratele de disociere ale apei și procesul invers vor fi din nou egale. Dacă concentrația soluției de HCl rezultată este de 0,1 mol/l, concentrația de echilibru va fi egal cu:
= 10 -14 /0,1 = 10 -13 mol/l
La adăugarea bazei puternice NaOH, deplasarea va fi către o scădere a concentrației de H +.
Apa pură, deși slabă (în comparație cu soluțiile electrolitice), poate conduce curentul electric. Acest lucru este cauzat de capacitatea unei molecule de apă de a se dezintegra (disocia) în doi ioni, care sunt conductori de curent electric în apa pură (mai jos, disocierea înseamnă disociere electrolitică - descompunere în ioni): H 2 O ↔ H + + OH -
Pentru aproximativ 556.000.000 de molecule de apă nedisociate, doar 1 moleculă se disociază, dar aceasta este 60.000.000.000 de molecule disociate în 1 mm 3. Disocierea este reversibilă, adică ionii H + și OH - pot forma din nou o moleculă de apă. Ca rezultat, apare un echilibru dinamic în care numărul de molecule degradate este egal cu numărul de ioni H + și OH - formați. Cu alte cuvinte, vitezele ambelor procese vor fi egale. Pentru cazul nostru, ecuația pentru viteza unei reacții chimice poate fi scrisă după cum urmează:
υ 1 = κ 1 (pentru disocierea apei)
υ 2 = κ 2 (pentru procesul invers)
unde υ este viteza de reacție; κ este constanta vitezei de reacție (în funcție de natura reactanților și de temperatură); , și - concentrații (mol/l).
Într-o stare de echilibru υ 1 = υ 2, deci: κ 1 = κ 2
Întrucât, la o anumită temperatură, cantitățile folosite la calcularea produsului ionic al apei (K, ) sunt constante, valoarea produsului ionic al apei este și ea constantă. Și întrucât disocierea unei molecule de apă produce același număr de ioni și , rezultă că pentru apă pură concentrațiile și vor fi egale cu 10 -7 mol/l. Din constanța produsului ionic al apei, rezultă că, dacă numărul de ioni H + devine mai mare, atunci numărul de ioni HO - devine mai mic. De exemplu, dacă se adaugă un acid HCl puternic la apa pură, acesta, ca electrolit puternic, se va disocia complet în H + și Cl -, ca urmare, concentrația de ioni de H + va crește brusc și acest lucru va duce la o creștere a vitezei procesului opus disocierii, deoarece depinde de concentrația ionilor H + și OH -: υ 2 = κ 2
În timpul procesului accelerat opus disocierii, concentrația ionilor HO - va scădea la o valoare corespunzătoare noului echilibru, la care vor fi atât de puțini, încât ratele de disociere ale apei și procesul invers vor fi din nou egale. Dacă concentrația soluției de HCl rezultată este de 0,1 mol/l, concentrația de echilibru va fi egală cu: = 10 -14 /0,1 = 10 -13 mol/l
Produs ionic al apeí este produsul concentrațiilor ionilor de hidrogen H + și ionilor hidroxil OH − în apă sau în soluții apoase, constanta de autoprotoliză a apei.
Apa, deși este un electrolit slab, se disociază într-o mică măsură:
Echilibrul acestei reacții este puternic deplasat spre stânga. Constanta de disociere a apei poate fi calculată folosind formula:
· - concentraţia ionilor de hidroniu (protoni);
· - concentraţia ionilor de hidroxid;
· - concentraţia apei (sub formă moleculară) în apă;
Concentrația apei în apă, ținând cont de gradul scăzut de disociere al acesteia, este practic constantă și se ridică la (1000 g/l)/(18 g/mol) = 55,56 mol/l.
La 25 °C, constanta de disociere a apei este 1,8 10 −16 mol/l. Ecuația (1) poate fi rescrisă ca:
Constanta K in, egală cu produsul dintre concentrațiile de protoni și ionii hidroxid, se numește produsul ionic al apei.. Este constantă nu numai pentru apa pură, ci și pentru soluțiile apoase diluate de substanțe. Odată cu creșterea temperaturii, disocierea apei crește, prin urmare, crește și Kv, cu scăderea temperaturii - invers. Semnificație practică Produsul ionic al apei este mare, deoarece permite, cu o aciditate (alcalinitate) cunoscută a oricărei soluții (adică la o concentrație cunoscută sau ), să se găsească concentrația corespunzătoare sau . Deși, în majoritatea cazurilor, pentru comoditatea prezentării, ele nu folosesc valori absolute ale concentrațiilor, ci logaritmii lor zecimale luați cu semnul opus - respectiv, indicele de hidrogen (pH) și indicele hidroxil (pOH).
Deoarece Kb este o constantă, atunci când în soluție se adaugă acid (ioni H +), concentrația ionilor de hidroxid OH − va scădea și invers. Într-un mediu neutru = = mol/l. La o concentrație > 10 −7 mol/l (respectiv, concentrația< 10 −7 моль/л) среда будет acru; La o concentrație > 10 −7 mol/l (respectiv, concentrația< 10 −7 моль/л) - alcalin.
27. Soluții tampon: compoziția lor, proprietăți, mecanism de acțiune. Capacitate tampon
Soluții tampon- acestea sunt soluții care conțin sisteme tampon. Sistemele tampon sunt amestecuri care conțin acizi slabi și sărurile acestora cu baze tari sau baze slabe și sărurile lor cu acizi tari într-un anumit raport cantitativ. Astfel de soluții au o concentrație stabilă de ioni H+ atunci când sunt diluate cu un solvent neutru (apă) și li se adaugă o anumită cantitate de acizi sau baze puternice.
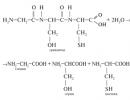
Soluțiile tampon se găsesc în apele oceanelor lumii, soluții de sol și organismele vii. Aceste sisteme îndeplinesc funcțiile de reglare care mențin o reacție activă a mediului la o anumită valoare necesară pentru apariția cu succes a reacțiilor metabolice. Soluțiile tampon sunt clasificate în acide și bazice. Un exemplu al primului ar fi un sistem tampon cu acetat, iar un exemplu al celui din urmă ar fi un sistem tampon cu amoniu. Există soluții tampon naturale și artificiale. O soluție tampon naturală este sângele, care conține sisteme tampon de bicarbonat, fosfat, proteine, hemoglobină și acid. O soluție tampon artificială poate fi un tampon acetat constând din CH3COOH.
Particularități compoziţia internă Să luăm în considerare mecanismul de acțiune al sistemelor tampon folosind exemplul unui sistem tampon acetat: acid acetat/acetat de sodiu. ÎN mediu acvatic componentele sistemului tampon suferă disociere electrolitică. Acetatul de sodiu, ca sare a unui acid slab și a unei baze puternice, se disociază complet în ioni. Prezența anionilor într-un astfel de amestec tampon depinde de concentrația de sare din acesta și de gradul de disociere a acestuia. Concentrația ionilor H+ în sistemul tampon este direct proporțională cu concentrația acidului din acesta și invers proporțională cu conținutul de sare a acestui acid din acesta.
Astfel, concentrația ionilor H+ din tamponul principal este direct proporțională cu concentrația de sare din acesta și invers proporțională cu concentrația de bază.
De exemplu, este necesar să se pregătească un tampon acetat cu mai multe valori ale pH-ului. Mai întâi, pregătiți soluții 5M de acid acetat și acetat de sodiu. Pentru a prepara prima soluție, luați 50 ml din fiecare componentă. Ghidați de formulă, determinați concentrația ionilor de H+ în soluția rezultată.
Pentru următoarea soluție tampon, luați 80 ml de soluție acidă și 20 ml de soluție de sare preparată mai devreme. Există o serie de rețete pentru diferite soluții tampon utilizate în analiză chimică si practica de laborator.
Soluțiile tampon se caracterizează prin anumite proprietăți. Acestea, în primul rând, includ tamponarea - capacitatea de a menține o concentrație constantă de ioni H+ atunci când la o soluție tampon se adaugă o anumită cantitate dintr-un acid puternic sau o bază puternică. De exemplu, dacă se adaugă o cantitate mică de acid clor în tamponul acetat, pH-ul nu se va schimba pe partea acidă, deoarece acidul clor va suferi o reacție de descompunere de schimb cu sarea acidului slab. Ca rezultat al reacției, un acid puternic care poate schimba pH-ul în partea acidă este înlocuit cu un acid slab și o sare neutră. Gradul de disociere al unei soluții slabe de electrolit scade pe măsură ce concentrația acesteia crește, tinde spre zero și nu are loc o schimbare a pH-ului.
Capacitatea soluției tampon(din engleza tampon- amortizor, engleza piele de bivol- atenuează șocurile) - cantitatea de acid sau bază necesară pentru a modifica pH-ul soluției tampon cu exact 1.
Amestecul tampon, soluție tampon, sistem tampon- o combinație de substanțe, un sistem care menține un pH constant.
Manualul este destinat studenților specialităților nechimice din învățământul superior. institutii de invatamant. Poate servi drept ghid pentru persoanele care studiază în mod independent elementele de bază ale chimiei și pentru studenții școlilor tehnice chimice și ai liceelor.
Un manual legendar, tradus în multe limbi din Europa, Asia, Africa și publicat într-un tiraj total de peste 5 milioane de exemplare.
La producerea fișierului a fost folosit site-ul http://alnam.ru/book_chem.php
Carte:
| <<< Назад
|
Înainte >>> |
Apa pură este un foarte slab conductor de electricitate, dar are încă o conductivitate electrică măsurabilă, care se explică prin disocierea ușoară a apei în ioni de hidrogen și ioni de hidroxid:
Pe baza conductivității electrice a apei pure, se poate calcula concentrația ionilor de hidrogen și hidroxid în apă. La 25°C este 10 -7 mol/l.
Să scriem o expresie pentru constanta de disociere a apei:
![]()
Să rescriem această ecuație după cum urmează:
Deoarece gradul de disociere al apei este foarte mic, concentrația moleculelor de H 2 O nedisociate în apă este aproape egală cu concentrația totală de apă, adică 55,55 mol/l (1 litru conține 1000 g de apă, adică 1000:18,02= 55,55 mol). În soluțiile apoase diluate, concentrația de apă poate fi considerată aceeași. Prin urmare, înlocuind produsul din ultima ecuație cu o nouă constantă K H 2 O vom avea:
![]()
Ecuația rezultată arată că pentru apă și soluții apoase diluate la o temperatură constantă, produsul dintre concentratul ionilor de hidrogen și ionii de hidroxid este o valoare constantă. Această valoare constantă se numește produsul ionic al apei. Valoarea sa numerică poate fi obținută cu ușurință prin înlocuirea concentrațiilor de ioni de hidrogen și hidroxid în ultima ecuație. În apă pură la 25°C ==1·10 -7 mol/l. Prin urmare, pentru temperatura specificată:
Soluțiile în care concentrațiile ionilor de hidrogen și ale ionilor de hidroxid sunt aceleași se numesc soluții neutre. La 25°C, după cum sa menționat deja, în soluții neutre concentrația atât a ionilor de hidrogen, cât și a ionilor de hidroxid este de 10 -7 mol/l. În soluții acide mai multa concentrare ioni de hidrogen, în cei alcalini - concentrația ionilor de hidroxid. Dar indiferent de reacția soluției, produsul dintre concentrațiile ionilor de hidrogen și ionilor de hidroxid rămâne constant.
Dacă, de exemplu, se adaugă suficient acid în apa pură, astfel încât concentrația ionilor de hidrogen să crească la 10 -3 mol/l, atunci concentrația ionilor de hidroxid va scădea astfel încât produsul să rămână egal cu 10 -14. Prin urmare, în această soluție concentrația ionilor de hidroxid va fi:
10-14/10-3 =10-11 mol/l
Dimpotrivă, dacă adăugați alcali în apă și creșteți astfel concentrația de ioni de hidroxid, de exemplu, la 10 -5 mol/l, atunci concentrația de ioni de hidrogen va fi:
10 -14 /10 -5 =10 -9 mol/l
Aceste exemple arată că dacă concentrația ionilor de hidrogen în soluție apoasă cunoscut, concentrația ionilor de hidroxid este astfel determinată. Prin urmare, atât gradul de aciditate, cât și gradul de alcalinitate al unei soluții pot fi caracterizate cantitativ prin concentrația de ioni de hidrogen:

Aciditatea sau alcalinitatea unei soluții poate fi exprimată într-un alt mod, mai convenabil: în loc de concentrația ionilor de hidrogen, indicați logaritmul său zecimal, luat cu semnul opus. Ultima valoare se numește indicele de hidrogen și se notează prin pH:
De exemplu, dacă =10 -5 mol/l, atunci pH=5; dacă = 10 -9 mol/l, atunci pH = 9 etc. De aici se vede clar că într-o soluție neutră (= 10 -7 mol/l) pH = 7. În soluții acide pH<7 и тем меньше, чем кислее раствор. Наоборот, в щелочных растворах pH>7 și cu cât mai mult, cu atât alcalinitatea soluției este mai mare.
Există diferite metode de măsurare a pH-ului. Reacția aproximativă a unei soluții poate fi determinată folosind reactivi speciali numiți indicatori, a căror culoare se schimbă în funcție de concentrația ionilor de hidrogen. Cei mai comuni indicatori sunt portocaliu de metil, roșu de metil și fenolftaleina. În tabel 17 furnizează caracteristicile unor indicatori.
Pentru multe procese, pH-ul joacă un rol rol important. Astfel, pH-ul sângelui uman și animal are o valoare strict constantă. Plantele pot crește în mod normal numai la valori ale pH-ului soluției de sol care se află într-un anumit interval caracteristic unui anumit tip de plantă. Proprietățile apelor naturale, în special corozivitatea lor, depind puternic de pH-ul acestora.
Tabelul 17. Indicatori cheie

| <<< Назад
|
Înainte >>> |
Apa pură, deși slabă (în comparație cu soluțiile electrolitice), poate conduce curentul electric. Acest lucru este cauzat de capacitatea unei molecule de apă de a se dezintegra (disocia) în doi ioni, care sunt conductori de curent electric în apa pură (mai jos, disocierea înseamnă disociere electrolitică - dezintegrare în ioni):
Indicele de hidrogen (pH) este o valoare care caracterizează activitatea sau concentrația ionilor de hidrogen în soluții. Indicatorul de hidrogen este desemnat pH. Indicele de hidrogen este numeric egal cu logaritmul zecimal negativ al activității sau concentrației ionilor de hidrogen, exprimat în moli pe litru: pH=-log[ H+ ] Dacă [ H+ ]>10-7mol/l, [ OH-]<10-7моль/л -среда кислая; рН<7.Если [ H+ ]<10-7 моль/л, [ OH-]>10-7mol/l - mediu alcalin; pH>7. Hidroliza sărurilor- aceasta este interacțiunea chimică a ionilor de sare cu ionii de apă, ducând la formarea unui electrolit slab. 1). Hidroliza nu este posibilăSare formată dintr-o bază tare și un acid tare ( KBr, NaCl, NaNO3), nu va suferi hidroliză, deoarece în acest caz nu se formează un electrolit slab pH-ul unor astfel de soluții = 7. Reacția mediului rămâne neutră. 2). Hidroliza prin cation (doar cationul reactioneaza cu apa). Într-o sare formată dintr-o bază slabă și un acid tare
(FeCl2,NH4Cl, Al2(SO4)3,MgSO4)
Cationul suferă hidroliză:
FeCl2 + HOH<=>Fe(OH)Cl + HCl Fe2+ + 2Cl- + H+ + OH-<=>FeOH+ + 2CI- + H+
Ca urmare a hidrolizei, se formează un electrolit slab, ion H+ și alți ioni. pH-ul soluției< 7 (раствор приобретает кислую реакцию). 3). Гидролиз по аниону (в реакцию с водой вступает только анион). Соль, образованная сильным основанием и слабой кислотой
(KClO, K2SiO3, Na2CO3,CH3COONa)
suferă hidroliză la nivelul anionului, ducând la formarea unui electrolit slab, ion hidroxid OH- și alți ioni.
K2SiO3 + HOH<=>KHSiO3 + KOH 2K+ +SiO32- + H+ + OH-<=>НSiO3- + 2K+ + ОН-
pH-ul unor astfel de soluții este > 7 (soluția devine alcalină). Hidroliza articulațiilor (atât cationul, cât și anionul reacţionează cu apa). Sare formată dintr-o bază slabă și un acid slab
(CH 3COONH 4, (NH4)2CO3, Al2S3),
hidrolizează atât cationul, cât și anionul. Ca rezultat, se formează o bază și un acid ușor disociante. pH-ul soluțiilor de astfel de săruri depinde de puterea relativă a acidului și a bazei. O măsură a puterii unui acid și a unei baze este constanta de disociere a reactivului corespunzător. Reacția mediului acestor soluții poate fi neutră, ușor acidă sau ușor alcalină:
Al2S3 + 6H2O => 2Al(OH)3v+ 3H2S^
Hidroliza este un proces reversibil. Hidroliza este ireversibilă dacă reacția are ca rezultat formarea unei baze insolubile și (sau) a unui acid volatil.
Apa pură este un conducător slab al electricității, dar are încă o conductivitate electrică măsurabilă, care se explică prin disocierea parțială a moleculelor de H2O în ioni de hidrogen și ioni de hidroxid:
H 2 O H + + OH –
Pe baza conductivității electrice a apei pure, se poate calcula concentrația de ioni H + și OH – în ea. La 25 o C este egal cu 10 –7 mol/l.
Constanta de disociere a H2O se calculează după cum urmează:
Să rescriem această ecuație:
Trebuie subliniat faptul că această formulă conţine concentraţii de echilibru ale moleculelor de H 2 O, ioni H + şi OH –, care au fost stabilite în momentul echilibrului în reacţia de disociere a H 2 O.
Dar, întrucât gradul de disociere al H 2 O este foarte mic, putem presupune că concentrația moleculelor de H 2 O nedisociate în momentul echilibrului este practic egală cu concentrația inițială totală a apei, adică. 55,56 mol/dm 3 (1 dm 3 H 2 O conţine 1000 g de H 2 O sau 1000: 18 ≈ 55,56 (moli). În soluţii apoase diluate, putem presupune că concentraţia de H 2 O va fi aceeaşi. Prin urmare , înlocuind în ecuația (42) produsul a două mărimi constante cu o nouă constantă (sau K W ), vom avea:
Ecuația rezultată arată că pentru apă și soluții apoase diluate la o temperatură constantă, produsul dintre concentrațiile molare ale ionilor de hidrogen și ionilor de hidroxid este o valoare constantă. Se numește altfel produs ionic al apei .
În apă curată la 25 ° C.
Prin urmare, pentru temperatura specificată:
Pe măsură ce temperatura crește, valoarea crește. La 100 o C ajunge la 5,5 ∙ 10 –13 (Fig. 34).
Orez. 34. Dependența constantei de disociere a apei K w
de la temperatura t(°C)
Se numesc soluții în care concentrațiile ionilor H + și OH – sunt aceleași soluții neutre. ÎN acru soluțiile conțin mai mulți ioni de hidrogen și alcalin– ioni de hidroxid. Dar indiferent de reacția mediului în soluție, produsul concentrațiilor molare ale ionilor H + și OH – va rămâne constant.
Dacă, de exemplu, la H 2 O pur se adaugă o anumită cantitate de acid și concentrația de ioni H + crește la 10 -4 mol/dm 3, atunci concentrația de ioni OH - va scădea în mod corespunzător, astfel încât produsul să rămână egal la 10 -14. Prin urmare, în această soluție concentrația ionilor de hidroxid va fi egală cu 10 -14: 10 -4 = 10 -10 mol/dm 3. Acest exemplu arată că dacă se cunoaște concentrația ionilor de hidrogen într-o soluție apoasă, atunci se determină și concentrația ionilor de hidroxid. Prin urmare, reacția soluției poate fi caracterizată cantitativ prin concentrația de ioni H +:
soluție neutră ®
soluție acidă ®
soluție alcalină ®
În practică, pentru a caracteriza cantitativ aciditatea sau alcalinitatea unei soluții, nu concentrația molară conține ioni H + și logaritmul său zecimal negativ. Această cantitate se numește valoarea pH-ului și este notat cu pH :
pH = –lg
De exemplu, dacă , atunci pH = 2; dacă , atunci pH = 10. Într-o soluție neutră, pH = 7. În soluții acide, pH< 7 (и тем меньше, чем «кислее» раствор, т.е., чем больше в нём концентрация ионов Н +). В щёлочных растворах рН >7 (și cu cât mai mult, cu atât soluția este mai „alcalină”, adică cu atât concentrația ionilor de H + în ea este mai mică).
Există diferite metode de măsurare a pH-ului unei soluții. Este foarte convenabil să se estimeze aproximativ reacția unei soluții folosind reactivi speciali numiți indicatori acido-bazici . Culoarea acestor substanțe în soluție se modifică în funcție de concentrația ionilor de H + din aceasta. Caracteristicile unora dintre cei mai comuni indicatori sunt prezentate în Tabelul 12.
Tabelul 12. Cei mai importanți indicatori acido-bazici