Energija veze sa n. Osnovne vrste hemijskih veza. Karakteristike hemijskog vezivanja. Energija komunikacije. Dužina veze. Dužina hemijske veze
Kada se formira hemijska veza, dolazi do preraspodele u prostoru elektronskih gustoća koje su prvobitno pripadale različitim atomima. Budući da su elektroni vanjskog nivoa najmanje čvrsto vezani za jezgro, ovi elektroni igraju glavnu ulogu u formiranju kemijske veze. Broj hemijskih veza koje formira dati atom u jedinjenju naziva se valencija. Elektroni koji sudjeluju u formiranju kemijske veze nazivaju se valentnim: za s- i p elemente to su vanjski elektroni, za d-elemente vanjski (poslednji) s-elektroni i pretposljednji d-elektroni. Sa energetske tačke gledišta, najstabilniji atom je onaj čiji vanjski nivo sadrži maksimalan broj elektrona (2 i 8 elektrona). Ovaj nivo se naziva kompletan. Završeni nivoi su veoma izdržljivi i karakteristični su za atome plemenitog gasa, tako da su u normalnim uslovima u stanju hemijski inertnog monoatomskog gasa.
Atomi drugih elemenata imaju nepotpune vanjske energetske nivoe. U procesu hemijske reakcije postiže se završetak spoljašnjih nivoa, što se postiže dodavanjem ili gubitkom elektrona, kao i formiranjem zajedničkih elektronskih parova. Ove metode dovode do formiranja dva glavna tipa veza: kovalentne i ionske. Dakle, kada se formira molekul, svaki atom teži da stekne stabilnu spoljašnju elektronsku ljusku: ili dvoelektronsku (dublet) ili osmoelektronsku (oktet). Ovaj obrazac čini osnovu teorije stvaranja hemijskih veza. Formiranje hemijske veze usled završetka spoljašnjih nivoa u atomima koji formiraju vezu je praćeno oslobađanjem velike količine energije, odnosno formiranje hemijske veze uvek teče egzotermno, jer dovodi do pojave novih čestica (molekula) koje su u normalnim uslovima stabilnije i samim tim manje energije od originalnih. Jedan od bitnih pokazatelja koji određuju kakva se veza stvara između atoma je elektronegativnost, odnosno sposobnost atoma da privuče elektrone iz drugih atoma. Elektronegativnost atoma elemenata se postepeno mijenja: u periodima periodnog sistema slijeva na desno njena vrijednost raste, a u grupama odozgo prema dolje opada.
Hemijska veza nastala zbog formiranja zajedničkih (vezujućih) elektronskih parova naziva se kovalentna.1) Razmotrimo primjer formiranja hemijske veze između atoma iste elektronegativnosti, na primjer, molekule vodika H2. formiranje hemijske veze u molekuli vodonika može se predstaviti kao dve tačke: H- + -H -> H: H ili crtica koja simbolizuje par elektrona: H-H Kovalentna veza koju formiraju atomi sa istom elektronegativnošću naziva se ne -polarni. Takvu vezu formiraju dvoatomski molekuli koji se sastoje od atoma jednog hemijskog elementa: H 2, Cl 2 itd. 2) Formiranje kovalentne veze između atoma čija se elektronegativnost neznatno razlikuje. Kovalentna veza koju formiraju atomi različite elektronegativnosti naziva se polarnom. U kovalentnoj polarnoj vezi, gustoća elektrona iz zajedničkog para elektrona se pomjera na atom s višom elektronegativnošću. Primjeri uključuju molekule H2O, NH3, H2S, CH3Cl. Kovalentna (polarna i nepolarna) veza u našim primjerima nastala je zbog nesparenih elektrona veznih atoma. Ovaj mehanizam stvaranja kovalentne veze naziva se razmjena. Drugi mehanizam za formiranje kovalentne veze je donor-akceptor. U ovom slučaju, veza nastaje zbog dva uparena elektrona jednog atoma (donor) i slobodne orbitale drugog atoma (akceptora). Dobro poznat primjer je formiranje amonijum jona: H++:NH 3 -> [H: NH3 | +<=====>NH4+ akceptor amonijum jona donor elektrona. Kada se formira amonijum ion, elektronski par dušika postaje zajednički za N i H atome, odnosno pojavljuje se četvrta veza, koja se ne razlikuje od ostale tri. Oni su prikazani na isti način:
Jonska veza nastaje između atoma čija se elektronegativnost naglo razlikuje. Razmotrimo način formiranja na primjeru natrijum hlorida NaCl. Elektronska konfiguracija atoma natrijuma i hlora može se predstaviti kao: 11 Na ls2 2s2 2p 6 3s1; 17 Cl ls2 2p 6 Zs2 3r5 Kao što su to atomi sa nepotpunim energetskim nivoima. Očigledno, da bi ih dovršio, atomu natrija je lakše da odustane od jednog elektrona nego da dobije sedam, a atomu hlora lakše je dobiti jedan elektron nego sedam. Tokom hemijske interakcije, atom natrijuma potpuno odustaje od jednog elektrona, a atom hlora ga prihvata. Šematski, ovo se može napisati na sljedeći način: Na. -- l e --> Na+ natrijum jon, stabilna osmoelektronska 1s2 2s2 2p6 ljuska zbog drugog energetskog nivoa. :Cl + 1e -->.Cl - jon hlora, stabilna ljuska od osam elektrona. Između Na+ i Cl- iona nastaju sile elektrostatičkog privlačenja, što rezultira stvaranjem jedinjenja.
Hemijska veza koja nastaje elektrostatičkim privlačenjem između jona naziva se jonska veza. Jedinjenja nastala privlačenjem jona nazivaju se jonskim. Jonska jedinjenja sastoje se od pojedinačnih molekula samo u stanju pare. U čvrstom (kristalnom) stanju, jonska jedinjenja sastoje se od pravilno raspoređenih pozitivnih i negativnih jona. U ovom slučaju nema molekula. Jonska jedinjenja čine elemente glavnih podgrupa grupa I i II i glavnih podgrupa grupa VI i VII koje se oštro razlikuju po elektronegativnosti. Postoji relativno malo jonskih jedinjenja. Na primjer, anorganske soli: NH4Cl (jon amonijuma NH4 + i jon hlora Cl-), kao i organska jedinjenja nalik solima: alkoholati, soli karboksilnih kiselina, soli amina. Nepolarne kovalentne veze i jonske veze su dva granična slučaja elektronske gustine distribucija. Nepolarna veza odgovara ravnomernoj raspodeli povezivanja dva elektronska oblaka između identičnih atoma. Naprotiv, u ionskoj vezi povezujući elektronski oblak gotovo u potpunosti pripada jednom od atoma. U većini jedinjenja, hemijske veze su između ovih vrsta veza, odnosno sadrže polarnu kovalentnu vezu.
Metalna veza postoji u metalima u čvrstom i tekućem stanju. U skladu sa svojim položajem u periodnom sistemu, atomi metala imaju mali broj valentnih elektrona (1-3 elektrona) i nisku energiju jonizacije (uklanjanje elektrona). Stoga se valentni elektroni slabo drže u atomu, lako se odvajaju i imaju sposobnost da se kreću kroz kristal. U čvorovima kristalne rešetke metala nalaze se slobodni atomi, pozitivno nabijeni elektroni, a neki od valentnih elektrona, koji se slobodno kreću u volumenu kristalne rešetke, tvore "elektronski plin" koji osigurava vezu između atoma metala. Veza koju vrše relativno slobodni elektroni između metalnih jona u kristalnoj rešetki naziva se metalna veza. Metalna veza nastaje zbog dijeljenja valentnih elektrona od strane atoma. Međutim, postoji značajna razlika između ovih vrsta komunikacije. Elektroni koji izvode kovalentnu vezu uglavnom se nalaze u neposrednoj blizini dva vezana atoma. U slučaju metalne veze, elektroni koji izvode vezu kreću se po komadu metala. Ovo određuje opšte karakteristike metala: metalni sjaj, dobru provodljivost toplote i električne energije, savitljivost, duktilnost itd. Opšte hemijsko svojstvo metala je njihova relativno visoka redukciona sposobnost.
Vodikove veze mogu se formirati između atoma vodika vezanog za atom elektronegativnog elementa i elektronegativnog elementa koji ima slobodan par elektrona (O,F,N). Vodikova veza je uzrokovana elektrostatičkim privlačenjem, što je olakšano malom veličinom atoma vodika, a dijelom i interakcijom donor-akceptor. Vodikova veza može biti intermolekularna ili intramolekularna. 0-H veze imaju izražen polarni karakter: vodonična veza je mnogo slabija od jonske ili kovalentne veze, ali jača od međumolekularne interakcije. Vodikove veze određuju neka fizička svojstva tvari (na primjer, visoke točke ključanja). Vodikove veze su posebno česte u molekulima proteina, nukleinskih kiselina i drugih biološki važnih spojeva, dajući im određenu prostornu strukturu (organizaciju).
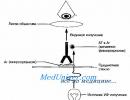
Energija vezivanja (Eb). Količina energije koja se oslobađa tokom formiranja hemijske veze naziva se energija hemijske veze [kJ/mol]. Za poliatomska jedinjenja uzima se njegova prosječna vrijednost. Što je više Eb, to je molekul stabilniji.
Dužina komunikacije (lsv). Udaljenost između jezgara u vezi. Što je dužina veze duža, to je niža energija veze.
Metoda valentne veze.
- A) hemijska veza između dva atoma nastaje kao rezultat preklapanja AO sa formiranjem elektronskih parova.
- B) atomi koji ulaze u hemijsku vezu međusobno razmjenjuju elektrone koji formiraju vezne parove. Energija razmjene elektrona između atoma (energija privlačenja atoma) daje glavni doprinos energiji kemijske veze. Dodatni doprinos energiji vezivanja daju Kulonove sile interakcije čestica.
- C) u skladu sa Paulijevim principom, hemijska veza nastaje samo kada su u interakciji elektroni sa različitim spinovima.
- D) karakteristike hemijske veze (energija, dužina, polaritet) određene su vrstom preklapanja AO.
Metoda valentne veze. Kovalentna veza je usmjerena prema maksimalnom preklapanju AO reagujućih atoma.
Valence. Sposobnost atoma da veže ili zamijeni određeni broj drugih atoma kako bi formirao kemijske veze.
Prilikom prelaska u pobuđeno stanje, jedan od uparenih elektrona prelazi u praznu orbitalu iste ljuske.
Mehanizam donor-akceptor: zajednički elektronski par nastaje zbog usamljenog para elektrona jednog atoma i prazne orbitale drugog atoma.
Molekularna orbitalna metoda. Elektroni u molekulu su raspoređeni među MO, koji se, kao i AO, odlikuju određenom energijom i oblikom. MO pokrivaju cijeli molekul. Molekul se smatra jednim sistemom.
- 1. Broj MO-ova jednak je ukupnom broju AO-a od kojih su MO-ovi kombinovani.
- 2. Energija nekih MO se ispostavlja da je veća, dok su drugi niži od energije originalnih AO. Prosječna energija MO dobijena iz skupa AO približno se poklapa sa prosječnom energijom ovih AO.
- 3. Elektroni ispunjavaju MO, poput AO, po redu porasta energije, dok se poštuje Paulijev princip isključenja i Hundovo pravilo.
- 4. AO se najefikasnije kombinuju sa onim AO koje karakterišu uporedive energije i odgovarajuća simetrija.
- 5. Kao iu BC metodi, jačina veze u MO metodi je proporcionalna stepenu preklapanja atomskih orbitala.
Energija reda i veze. Red komunikacije je n=(Nsv-Nr)/2. Nb je broj e u vezivnim molekularnim orbitalama, Nr je broj e u antivezujućim molekularnim orbitalama.
Ako je Nsv = Nr, tada je n=0 i molekul se ne formira. Kako n raste, energija vezivanja u molekulima istog tipa raste. Za razliku od AO metode, MO metoda dozvoljava da vezu može formirati jedan elektron.
Kompleksne veze. Kompleksna jedinjenja koja imaju kovalentne veze formirane prema mehanizmu donor-akceptor
Energija komunikacije je energija koja se oslobađa kada se molekul formira od pojedinačnih atoma. Energija vezivanja je energija koja se apsorbira kada se dva atoma udalje jedan od drugog na beskonačnoj udaljenosti. A entalpija formiranja je toplina koja se oslobađa kada se supstanca dobije iz jednostavnih supstanci, odnosno, ako govorimo jezikom vezanih energija, prvo se atomi jednostavnih supstanci rašire na beskonačno veliku udaljenost (uz apsorpciju energije), zatim se kombinuju i formiraju željenu supstancu (energija se oslobađa). Razlika je u entalpiji formiranja.
Energija vezivanja se razlikuje od ΔH arr. Toplota formiranja je energija koja se oslobađa ili apsorbuje tokom formiranja molekula iz jednostavnih supstanci. dakle:
N 2 + O 2 → 2NO + 677,8 kJ/mol – ∆H arr.
N + O → NO - 89,96 kJ/mol – E St.
Za dvoatomske molekule energija veze je jednaka energiji disocijacije, uzetoj sa suprotnim predznakom: na primjer, u molekuli F 2, energija veze između F-F atoma je jednaka - 150,6 kJ/mol.
Za poliatomske molekule s jednom vrstom veze, na primjer, za molekule AB n, prosječna energija veze jednaka je 1/n dio ukupne energije formiranja spoja iz atoma. Dakle, energija formiranja CH 4 = -1661,1 kJ/mol. Pošto u molekulu CH 4 postoje četiri veze, energija jedne C – H veze je 415,3 kJ/mol. Ispitivanje velikog broja trenutno poznatih podataka o energijama vezivanja pokazuje da je energija vezivanja između određenog para atoma često konstantna, pod uslovom da se ostatak molekula malo mijenja. Dakle, u zasićenim ugljovodonicima Eb (C – H) = 415,3 kJ/mol, Eb (C – C) = 331,8 kJ/mol.
Energije veze u molekulima koji se sastoje od identičnih atoma smanjuju se u grupama od vrha do dna. Energije veze rastu tokom perioda. Afinitet elektrona se takođe povećava u istom pravcu.
U zadnjem pasusu dali smo primjer izračunavanja toplotnog efekta reakcije:
C(tv) + 2 H 2 (g) = CH 4 (g) + 76 kJ/mol.
U ovom slučaju, 76 kJ nije samo toplotni efekat ove hemijske reakcije, već takođe toplota stvaranja metana iz elemenata .
ENTALPIJA je toplotni efekat reakcije, izmeren (ili izračunat) za slučaj kada se reakcija odvija u otvorenom sudu (tj. pri konstantnom pritisku). Označava se kao ΔH.
Kada je zapremina koju zauzimaju produkti reakcije različita od zapremine koju zauzimaju reaktanti, hemijski sistem može da izvrši dodatni rad PΔV (gde je P pritisak, a ΔV promena zapremine). Stoga su ΔH i ΔE međusobno povezani odnosom:
ΔH = ΔE + PΔV
Dakle, ako se reakcija ne izvede u "bombi", onda se ENTALPIJA i TERMIČKI EFEKAT međusobno poklapaju. Entalpija se još naziva i "sadržaj toplote". Ako izvedemo reakciju za proizvodnju vode u otvorenoj posudi, tada je 286 kJ/mol “toplina” ΔH sadržana u vodiku i kisiku za slučaj kada iz njih dobijemo vodu. Budući da su polazne supstance (vodik i kiseonik) u našem eksperimentu bile u standardnim uslovima (25 o C i pritisak od 1 atm), a da smo i produkt reakcije (vodu) doveli u standardne uslove, imamo pravo reći da je 286 kJ/mol je STANDARDNA TOPLOTA STVARANJA VODE ili, što je isto - STANDARDNA ENTALPIJA NASTANKA VODE. Ako iz istih elemenata dobijemo ne vodu, već vodikov peroksid H 2 O 2, tada će “sadržaj topline” takvog kemijskog sistema biti drugačiji (187,6 kJ/mol). Tokom reakcija koje proizvode 1 mol vode ili 1 mol H 2 O 2, oslobađaju se različite količine energije, kako bi se i očekivalo. U nastavku ćemo češće označavati standardnu toplinu stvaranja tvari kao standardna entalpija formiranja ΔH. Da bi se naglasila valjanost ove vrijednosti samo za standard uslovima, u tabelama je označeno na sledeći način: ΔN oko 298
Mala “nula” pored ΔH tradicionalno simbolizira određeno standardno stanje, a broj 298 nas podsjeća da su vrijednosti date za tvari na 25 o C (ili 298 K). Standardna entalpija nije potrebno mora biti entalpija stvaranja supstance od elemenata. Možete dobiti standardnu vrijednost entalpije ΔH oko 298 za bilo koju kemijsku reakciju. Ali u našem slučaju, proizvodnjom vode iz vodika i kiseonika, dobili smo tačno standardnu entalpiju stvaranja vode. Piše se ovako: H 2 + 0,5 O 2 = H 2 O (ΔH o 298 = -286 kJ/mol)
Odakle dolazi znak minus ispred vrijednosti termičkog efekta? Ovdje autor, uz uzdah, mora obavijestiti čitaoca o još jednoj osobini prikaza topline (i entalpije) u termodinamici. Ovdje je prihvaćeno izgubljen predstavljaju energiju bilo kojim sistemom sa znakom minus. Razmotrimo, na primjer, već poznati sistem molekula metana i kisika. Kao rezultat egzotermna između njih dolazi do reakcija alokacija toplota: CH 4 (g) + 2 O 2 (g) = CO 2 (g) + 2 H 2 O (l) + 890 kJ
Ova reakcija se može napisati i drugom jednačinom, gdje oslobođena („izgubljena“) toplota ima predznak minus: CH 4 (g) + 2 O 2 (g) – 890 kJ = CO 2 (g) + 2 H 2 O (l )
Prema predanju, entalpija ovog i drugih egzotermna reakcije u termodinamici se obično pišu znakom "oduzeti": ΔH o 298 = –890 kJ/mol (oslobođena energija).
Naprotiv, ako kao rezultat endotermni reakcioni sistem apsorbuje energije, onda je entalpija takve endotermne reakcije zapisana predznakom "plus". Na primjer, za već poznatu reakciju proizvodnje CO i vodika iz uglja i vode (kada se zagrije): C(čvrsto) + H 2 O (g) + 131,3 kJ = CO (g) + H 2 (g)
(ΔH o 298 = +131,3 kJ/mol)
Samo se trebate naviknuti na ovu osobinu termodinamičkog jezika, iako u početku zabuna sa znakovima može biti prilično neugodna prilikom rješavanja problema.
Pokušajmo prvo riješiti isti problem termodinamički skali (gdje toplina oslobođena reakcijom ima predznak minus), a zatim in termohemijska skala (koju smo koristili u prethodnom pasusu i gdje energija oslobođena reakcijom ima znak plus).
Dakle, evo primjera izračunavanja toplotnog efekta reakcije: Fe 2 O 3 (s) + 3 C(grafit) = 2 Fe(s) + 3 CO(g)
Ova reakcija se odvija u visokoj peći na vrlo visokoj temperaturi (oko 1500 o C). U priručniku gdje se koristi termodinamički skali, možete pronaći standardne toplote formiranja Fe 2 O 3 (ΔH o 298 = –822,1 kJ/mol) i CO (ΔH o 298 = – 110,5 kJ/mol). Druge dvije tvari u ovoj jednadžbi, ugljik i željezo, su elementi, što znači da je njihova toplina formiranja po definiciji nula. Dakle, standardna toplota reakcije koja se razmatra je:
ΔH o 298 = 3× (-110,5) - (-822,1) = -331,5 + 822,1 = +490,6 kJ
Dakle, reakcija redukcije ugljika željezo(III) oksida je endotermni(ΔH o 298 je pozitivan!), te bi bilo potrebno potrošiti 490,6 kJ da se jedan mol Fe 2 O 3 reducira sa tri mola ugljika ako su početne tvari prije početka reakcije i produkti nakon završetka reakcije. reakcije su pod standardnim uslovima (tj. na sobnoj temperaturi i atmosferskom pritisku). Nema veze što su polazni materijali morali biti jako zagrijani da bi reakcija nastupila. Vrijednost ΔH o 298 = +490,6 kJ odražava “čisti” toplinski učinak endotermne reakcije, u kojoj su reaktanti prvo zagrijavani vanjskim izvorom topline od 25 do 1500 o C, a na kraju reakcije su se proizvodi ohladili. ponovo na sobnu temperaturu, otpuštajući svu toplotu u okolinu. U tom slučaju će oslobođena toplina biti manja od one koju je trebalo potrošiti na zagrijavanje, jer se dio topline apsorbirao u reakciji.
Uradimo isti proračun koristeći termohemijska skala. Pretpostavimo da su toplote sagorevanja ugljika i gvožđa u kiseoniku poznate (pri konstantnom pritisku):
1) C + 1/2 O 2 = CO + 110,5 kJ
2) 2 Fe + 3/2 O 2 = Fe 2 O 3 + 822,1 kJ
Da bismo dobili toplotni efekat reakcije koja nas zanima, prvu jednačinu pomnožimo sa 3, a drugu prepišemo obrnutim redom:
1) 3 C + 3/2 O 2 = 3 CO + 331,5 kJ
2) Fe 2 O 3 + 822,1 kJ = 2 Fe + 3/2 O 2
Sada dodajmo obje jednadžbe pojam po član: 3 C + 3/2 O 2 + Fe 2 O 3 + 822,1 kJ = 3 CO + 331,5 kJ + 2 Fe + 3/2 O 2
Nakon redukcije obe strane jednačine kiseonika (3/2 O 2) i prenošenja 822,1 kJ na desnu stranu, dobijamo: 3 C + Fe 2 O 3 = 3 CO + 2 Fe – 490,6 kJ
kinetika hemijskih reakcija- grana fizičke hemije koja proučava obrasce nastanka hemijskih reakcija tokom vremena, zavisnost ovih obrazaca od spoljašnjih uslova, kao i mehanizme hemijskih transformacija. Hemijska kinetika je nauka o brzinama i obrascima nastanka hemijskih procesa tokom vremena.
Hemijska kinetika proučava mehanizam procesa, tj. one međuetape koje se sastoje od elementarnih radnji kroz koje sistem prelazi iz početnog stanja u konačno stanje.
Hemijska kinetika proučava stope ovih koraka i faktore koji utiču na njihovu brzinu.
Jednačina hemijske reakcije pokazuje početno stanje sistema (početne supstance) i njegovo konačno stanje (produkti reakcije), ali ne odražava mehanizam procesa.
Ulaznica broj 10.
1.Karakteristike hemijske veze - energija, dužina, višestrukost, polaritet.
Razlog za stvaranje hemijske veze.
Hemijska veza je skup interakcija između atoma koje dovode do formiranja stabilnih sistema (molekula, kompleksa, kristala.). Nastaje ako se, kao rezultat preklapanja oblaka atoma, smanji ukupna energija sistema. Mjera čvrstoće je energija veze, koja je određena radom potrebnim za prekid date veze.
Vrste hemikalija veze: kovalentne (polarne, nepolarne, izmjenjivačke i donor-akceptorske), jonske, vodikove i metalne.
Dužina veze je udaljenost između centara atoma u molekuli. Energija i dužina veza zavise od prirode El distribucije. gustina između atoma. Na distribuciju njegove gustine utiče prostorna orijentacija hemikalije. komunikacije. Ako su 2-atomske molekule uvijek linearne, tada oblici poliatomskih molekula mogu biti su različiti.
Ugao između zamišljenih linija koji se može povući kroz centre vezanih atoma naziva se valencija. Distribucija e gustine zavisi i od veličine at. i njihov eo. U homoatomskom El. gustina je ravnomerno raspoređena. Kod heteroatomskih se pomiče u smjeru koji pomaže u smanjenju energije sistema.
Energija vezivanja je energija koja se oslobađa kada se molekul formira od pojedinačnih atoma. Energija vezivanja se razlikuje od ΔHobr. Toplota formiranja je energija koja se oslobađa ili apsorbuje tokom formiranja molekula iz jednostavnih supstanci. dakle:
N2 + O2 → 2NO + 677,8 kJ/mol – ∆Hobr.
N + O → NO - 89,96 kJ/mol – E St.
Višestrukost veze određena je brojem elektronskih parova uključenih u vezu između atoma. Hemijska veza je uzrokovana preklapanjem elektronskih oblaka. Ako se ovo preklapanje dogodi duž linije koja povezuje atomska jezgra, tada se takva veza naziva σ veza. Mogu ga formirati s – s elektroni, p – p elektroni, s – p elektroni. Hemijska veza koju ostvaruje jedan elektronski par naziva se jednostruka veza.
Ako vezu formira više od jednog para elektrona, onda se naziva višestruka.
Višestruka veza nastaje kada ima premalo elektrona i veznih atoma da bi se svaka valentna orbitala centralnog atoma koja stvara vezu preklapala s bilo kojom orbitalom okolnog atoma.
Budući da su p-orbitale striktno orijentirane u prostoru, one se mogu preklapati samo ako su p-orbitale svakog atoma okomite na međunuklearnu osu paralelne jedna s drugom. To znači da u molekulima s višestrukom vezom nema rotacije oko veze.
Ako se dvoatomska molekula sastoji od atoma jednog elementa, kao što su molekuli H2, N2, Cl2, itd., tada je svaki elektronski oblak formiran od zajedničkog para elektrona i koji ima kovalentnu vezu raspoređen u prostoru simetrično u odnosu na jezgra oba atoma. U tom slučaju, kovalentna veza se naziva nepolarna ili homeopolarna. Ako se dvoatomska molekula sastoji od atoma različitih elemenata, tada se ukupni elektronski oblak pomjera prema jednom od atoma, tako da dolazi do asimetrije u raspodjeli naboja. U takvim slučajevima, kovalentna veza se naziva polarna ili heteropolarna.
Za procjenu sposobnosti atoma datog elementa da privuče zajednički elektronski par, koristi se vrijednost relativne elektronegativnosti. Što je veća elektronegativnost atoma, to jače privlači zajednički elektronski par. Drugim riječima, kada se formira kovalentna veza između dva atoma različitih elemenata, zajednički elektronski oblak se pomiče na elektronegativniji atom, i to u većoj mjeri, što se više razlikuje elektronegativnost atoma u interakciji. Vrijednosti elektronegativnosti atoma nekih elemenata u odnosu na elektronegativnost fluora, za koju se pretpostavlja da je 4.
Elektronegativnost se prirodno mijenja ovisno o položaju elementa u periodnom sistemu. Na početku svakog perioda nalaze se elementi sa najnižom elektronegativnošću - tipični metali, na kraju perioda (pre plemenitih gasova) - elementi sa najvećom elektronegativnošću, odnosno tipični nemetali.
Za elemente iste podgrupe, elektronegativnost ima tendenciju smanjenja s povećanjem nuklearnog naboja. Dakle, što je neki element tipičniji za metal, to je niža njegova elektronegativnost; Što je neki element tipičniji za nemetal, to je veća njegova elektronegativnost.
Razlog za stvaranje hemijske veze. Atomi većine hemijskih elemenata ne postoje u pojedinačnom obliku, jer su u interakciji jedni s drugima, formirajući složene čestice (molekule, ione i radikale). Između atoma djeluju elektrostatičke sile, tj. sila interakcije električnih naboja, čiji su nosioci elektroni i atomska jezgra. Valentni elektroni igraju glavnu ulogu u formiranju hemijskih veza između atoma.
Razlozi za stvaranje hemijske veze između atoma mogu se tražiti u elektrostatičkoj prirodi samog atoma. Zbog prisustva prostorno razdvojenih područja električnog naboja u atomima, može doći do elektrostatičkih interakcija između različitih atoma koji mogu držati te atome zajedno.
Kada se formira hemijska veza, dolazi do preraspodele u prostoru elektronskih gustoća koje su u početku pripadale različitim atomima. Budući da su elektroni vanjskog nivoa najmanje čvrsto vezani za jezgro, ovi elektroni igraju glavnu ulogu u formiranju kemijske veze. Broj hemijskih veza koje formira dati atom u jedinjenju naziva se valencija. Iz tog razloga, elektroni vanjskog nivoa nazivaju se valentnim elektronima.
2.Karakteristike hemijske veze - energija, dužina, višestrukost, polaritet.
Energija vezivanja je energija koja se oslobađa kada se molekul formira od pojedinačnih atoma. Energija vezivanja se razlikuje od ΔHobr. Toplina formiranja je energija koja se oslobađa ili apsorbuje tokom formiranja molekula iz jednostavnih supstanci.(Energije veze u molekulima koji se sastoje od identičnih atoma smanjuju se u grupama od vrha do dna)
Za dvoatomske molekule energija veze je jednaka energiji disocijacije, uzetoj sa suprotnim predznakom: na primjer, u molekuli F2, energija veze između F-F atoma je jednaka - 150,6 kJ/mol. Za poliatomske molekule s jednom vrstom veze, na primjer, za ABn molekule, prosječna energija veze jednaka je 1/n dijelu ukupne energije formiranja spoja iz atoma. Dakle, energija formiranja CH4 = -1661,1 kJ/mol.
Ako je više od dva različita atoma spojeno u molekulu, tada se prosječna energija vezivanja ne poklapa s energijom disocijacije molekula. Ako molekul sadrži različite vrste veza, onda se svakoj od njih može približno dodijeliti određena vrijednost E. To nam omogućava da procijenimo energiju formiranja molekula iz atoma. Na primjer, energija formiranja molekule pentana iz atoma ugljika i vodika može se izračunati pomoću jednadžbe:
E = 4EC-C + 12EC-H.
Dužina veze je rastojanje između jezgara atoma u interakciji. Duljina veze može se grubo procijeniti na osnovu atomskog ili ionskog radijusa, ili iz rezultata određivanja veličine molekula korištenjem Avogadrovog broja. Dakle, zapremina po jednom molekulu vode: , o
Što je veći red veze između atoma, to je kraća.
Višestrukost: Višestrukost veze određena je brojem elektronskih parova uključenih u vezu između atoma. Hemijska veza je uzrokovana preklapanjem elektronskih oblaka. Ako se ovo preklapanje dogodi duž linije koja povezuje atomska jezgra, tada se takva veza naziva σ veza. Mogu ga formirati s – s elektroni, p – p elektroni, s – p elektroni. Hemijska veza koju ostvaruje jedan elektronski par naziva se jednostruka veza.
Ako vezu formira više od jednog para elektrona, onda se naziva višestruka.
Višestruka veza nastaje kada ima premalo elektrona i veznih atoma da bi se svaka valentna orbitala centralnog atoma koja stvara vezu preklapala s bilo kojom orbitalom okolnog atoma.
Budući da su p-orbitale striktno orijentirane u prostoru, one se mogu preklapati samo ako su p-orbitale svakog atoma okomite na međunuklearnu osu paralelne jedna s drugom. To znači da u molekulima s višestrukom vezom nema rotacije oko veze.
Polaritet: Ako se dvoatomska molekula sastoji od atoma jednog elementa, kao što su molekuli H2, N2, Cl2, itd., tada je svaki elektronski oblak formiran od zajedničkog para elektrona i koji ima kovalentnu vezu raspoređen u prostoru simetrično u odnosu na jezgra oba atoma. U tom slučaju, kovalentna veza se naziva nepolarna ili homeopolarna. Ako se dvoatomska molekula sastoji od atoma različitih elemenata, tada se ukupni elektronski oblak pomjera prema jednom od atoma, tako da dolazi do asimetrije u raspodjeli naboja. U takvim slučajevima, kovalentna veza se naziva polarna ili heteropolarna.
Za procjenu sposobnosti atoma datog elementa da privuče zajednički elektronski par, koristi se vrijednost relativne elektronegativnosti. Što je veća elektronegativnost atoma, to jače privlači zajednički elektronski par. Drugim riječima, kada se formira kovalentna veza između dva atoma različitih elemenata, zajednički elektronski oblak se pomiče na elektronegativniji atom, i to u većoj mjeri, što se više razlikuje elektronegativnost atoma u interakciji.
Pomicanje ukupnog elektronskog oblaka tokom formiranja polarne kovalentne veze dovodi do činjenice da je prosječna gustoća negativnog električnog naboja veća u blizini elektronegativnijeg atoma i niža u blizini manje elektronegativnog. Kao rezultat toga, prvi atom dobiva višak negativnog naboja, a drugi - višak pozitivnog naboja; Ova naelektrisanja se obično nazivaju efektivnim naelektrisanjem atoma u molekulu.
3. Razlog za stvaranje hemijske veze je želja atoma metala i nemetala da, interakcijom sa drugim atomima, postignu stabilniju elektronsku strukturu, sličnu strukturi inertnih gasova. Postoje tri glavne vrste veza: polarne kovalentne, nepolarne kovalentne i jonske.
Kovalentna veza se naziva nepolarna ako zajednički elektronski par dijele podjednako oba atoma. Kovalentna nepolarna veza nastaje između atoma čija je elektronegativnost ista (između atoma istog nemetala), tj. u jednostavnim supstancama. Na primjer, u molekulima kisika, dušika, hlora, broma, kovalentna veza je nepolarna.
Kovalentna veza se naziva polarnom ako je zajednički elektronski par pomaknut na jedan od elemenata. Polarna kovalentna veza se javlja između atoma čija se elektronegativnost razlikuje, ali ne mnogo, tj. u složenim supstancama između atoma nemetala. Na primjer, u molekulima vode, klorovodika, amonijaka i sumporne kiseline, veza je polarna kovalentna.
Jonska veza je veza između jona koja nastaje zbog privlačenja suprotno nabijenih iona. Jonske veze nastaju između atoma tipičnih metala (glavna podgrupa prve i druge grupe) i atoma tipičnih nemetala (glavna podgrupa sedme grupe i kiseonika).
4. Hemijska ravnoteža. Konstanta ravnoteže. Proračun ravnotežnih koncentracija.
Hemijska ravnoteža je stanje hemijskog sistema u kojem se jedna ili više hemijskih reakcija odvija reverzibilno, a brzine u svakom paru reakcija naprijed-nazad su jednake. Za sistem u hemijskoj ravnoteži, koncentracije reagensa, temperatura i drugi parametri sistema se ne menjaju tokom vremena.
A2 + B2 ⇄ 2AB
U stanju ravnoteže, brzine reakcije naprijed i nazad postaju jednake.
Konstanta ravnoteže je vrijednost koja za datu hemijsku reakciju određuje odnos između polaznih supstanci i proizvoda u stanju hemijske ravnoteže. Poznavajući konstantu ravnoteže reakcije, moguće je izračunati ravnotežni sastav reakcione smjese, maksimalni prinos proizvoda i odrediti smjer reakcije.
Načini da se izrazi konstanta ravnoteže:
Za reakciju u mješavini idealnih plinova, konstanta ravnoteže može se izraziti kao ravnotežni parcijalni pritisci komponenata pi prema formuli:
gdje je νi stehiometrijski koeficijent (uzet negativan za početne tvari, pozitivan za proizvode). Kp ne zavisi od ukupnog pritiska, od početnih količina supstanci, niti od toga koji su učesnici reakcije uzeti kao početni, već zavisi od temperature.
Na primjer, za reakciju oksidacije ugljičnog monoksida:
2CO + O2 = 2CO2
Konstanta ravnoteže može se izračunati pomoću jednačine:
![]()
Ako se reakcija odvija u idealnom rastvoru i koncentracija komponenti je izražena kao molarnost ci, konstanta ravnoteže ima oblik:
Za reakcije u mješavini stvarnih plinova ili u stvarnoj otopini, umjesto parcijalnog tlaka i koncentracije, koriste se fugacitet fi i aktivnost ai, redom:
U nekim slučajevima (ovisno o načinu izražavanja), konstanta ravnoteže može biti funkcija ne samo temperature, već i pritiska. Dakle, za reakciju u mješavini idealnih plinova, parcijalni tlak komponente može se izraziti prema Daltonovom zakonu u smislu ukupnog tlaka i molskog udjela komponente (), tada je lako pokazati da:
![]()
gdje je Δn promjena broja molova tvari tokom reakcije. Može se vidjeti da Kx zavisi od pritiska. Ako je broj molova produkta reakcije jednak broju molova polaznih supstanci (Δn = 0), tada je Kp = Kx.
Hibridizacija atomskih orbitala. Koncept molekularne orbitalne metode. Energetski dijagrami formiranja molekularnih orbitala za binarne homonuklearne molekule. Kada se formira hemijska veza, menjaju se svojstva atoma u interakciji i, iznad svega, energija i zauzetost njihovih spoljašnjih orbitala.
Podijelite svoj rad na društvenim mrežama
Ako vam ovaj rad ne odgovara, na dnu stranice nalazi se lista sličnih radova. Možete koristiti i dugme za pretragu
STRANA 13
Lebedev Yu.A. Predavanje 0 2
Predavanje br. 0 2
Hemijska veza. Karakteristike hemijske veze: energija, dužina, ugao veze. Vrste hemijskih veza. Polaritet komunikacije. Kvantnomehaničke ideje o prirodi kovalentnih veza. Koncept metode valentne veze. Hibridizacija atomskih orbitala.- (c igma) i  (pi)-veze. Geometrijska konfiguracija molekula. Električni dipolni moment molekula. Koncept molekularne orbitalne metode. Energetski dijagrami formiranja molekularnih orbitala za binarne homonuklearne molekule. Sigma (
(pi)-veze. Geometrijska konfiguracija molekula. Električni dipolni moment molekula. Koncept molekularne orbitalne metode. Energetski dijagrami formiranja molekularnih orbitala za binarne homonuklearne molekule. Sigma ( ) i Pi(
) i Pi(  )-molekularne orbitale. Dia- i paramagnetski molekuli.
)-molekularne orbitale. Dia- i paramagnetski molekuli.
PODSJETNIK
Schrödingerova jednadžba. - valna funkcija.
E= f (n, l, m, s).
Hemijska veza. Karakteristike hemijske veze: energija, dužina, ugao veze.
Ispitivali smo strukturu elektronskih nivoa izolovanih atoma. Ovo su vrlo rijetki objekti u praksi. Jedini izuzetak je inertni plin argon s elektronskom formulom 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 . I iako je u atmosferi “samo” 0,93% vol, svako od vas doslovno “proguta” oko tri stotine kvintiliona atoma argona u jednom dahu.
Sve ostale tvari i materijali s kojima imamo posla sadržehemijski povezaniatomi. Interakcija slobodnih atoma jedni s drugima dovodi do stvaranja molekula, jona i kristala. To su "klasični" hemijski objekti. Međutim, u posljednje vrijeme značajnu ulogu dobijaju objekti poput nanostruktura, površinskih spojeva, bertolida i niza drugih praktično važnih „neklasičnih“ hemijskih objekata.
Hemijska veza je uzrokovana interakcijom elektrona u vanjskim elektronskim omotačima atoma.One orbitale koje učestvuju u formiranju hemijske veze nazivaju sevalentne orbitale, a elektroni koji se nalaze na njima su valentni elektroni.
Kada se formira hemijska veza, menjaju se svojstva atoma u interakciji i, iznad svega, energija i zauzetost njihovih spoljašnjih orbitala.
Kada se formira hemijska veza, ukupna energija elektrona u valentnim orbitalama je manja od njihove energije u slobodnim atomima. Ova razlika u energiji naziva se energija hemijske veze.
Tipična vrijednost energije hemijske veze je stotine kJ/mol.
Važna kvantitativna karakteristika hemijske veze je njena dužina.Dužina veze je udaljenost između jezgara kemijski vezanih atoma u stabilnom stanju molekule.
Tipična dužina hemijske veze je desetinke nanometra. 1
Ako dva ili više drugih atoma učestvuju u formiranju molekule pri interakciji sa datim atomom, onda se postavlja pitanje o njegovoj geometrijskoj strukturi ili hemijskoj strukturi. Osnove teorije hemijske strukture molekula postavio je A.M. Butlerov 2
Jedna od najvažnijih kvantitativnih karakteristika strukture složenih molekula je vezni ugao - ugao koji formiraju dva smjera hemijskih veza koje izlaze iz jednog atoma.
Vrste hemijskih veza. Polaritet komunikacije.
Prema prirodi interakcije valentnih elektrona i vrsti orbitala nastalih tokom interakcije,hemijske veze se dijele na sljedeće glavne tipove:kovalentni (polarni i nepolarni), jonski, donor-akceptorski, vodikovi i intermolekularni (takođe zvani van der Waals).
Davne 1916. godine američki hemičar G.N. Lewis 3 izrazio je ideju da hemijsku vezu formira elektronski par, koji je grafički predstavljen valentnom linijom:
F + F = F 2 (F-F).
Ako je elektronegativnost atoma jednaka, onda se takva veza naziva nepolarna. Ako je drugačiji polarni.
Kada se formira polarna kovalentna veza, atomi dobijaju dodatni naboj: negativan za atom veće elektronegativnosti i pozitivan za atom sa nižom elektronegativnošću:
H+Cl = HCl ( 
 )
)
U slučaju kada je razlika u elektronegativnosti atoma u interakciji velika, veza smatra se jonskim:
Na + Cl = NaCl (Na + Cl - ).
Ako je elektronski par koji tvori vezu pripadao jednom od atoma prije interakcije, tada se takva veza naziva donor-akceptorska veza. Atom koji je dao elektronski par naziva se donor, a atom koji ga je prihvatio u slobodnu orbitalu naziva se akceptor.
Posebno je karakteristična pojava donor-akceptorskih veza d - metali koji su slobodni ili djelimično ispunjeni d -orbitale da formiraju kompleksna jedinjenja.
O drugim vrstama komunikacije ćemo kasnije.
Kvantnomehaničke ideje o prirodi kovalentnih veza.
Sa moderne tačke gledišta, kovalentna veza nastaje kvantno mehaničkom interakcijom svih elektrona svih atoma u interakciji. Ali, kao što smo već rekli u predavanju br. 1, ne postoji tačno rješenje Schrödingerove jednačine, koja opisuje orbitale mnogih elektrona u molekulima. Zadatak kvantnomehaničkog opisa hemijske veze pojednostavljen je činjenicom da je tokom njenog formiranja uloga elektrona koji se nalaze na unutrašnjoj i spoljašnjoj elektronskoj ljusci značajno drugačija.
Stoga je bilo moguće stvoriti različite približne metode za opisivanje hemijskih veza.
Kvantna hemija ima bogat arsenal aplikativnih programa koji omogućavaju proračune sa visokom preciznošću za široku klasu molekula i jona. 4
Međutim, još ne postoji univerzalni i dovoljno precizan kvantno hemijski algoritam.
Za kvalitativno razumijevanje strukture kemijskih spojeva koriste se dvije metodemetoda valentne veze (VBC) I molekularne orbitalne (MO) metode.
Koncept metode valentne veze. Geometrijska konfiguracija molekula. Električni dipolni moment molekula.
Glavni postulati metode valentne veze su:
1. Jednu kovalentnu hemijsku vezu izvode dva valentna elektrona, koji zauzimaju dve orbitale, po jednu iz svakog od atoma u interakciji. U ovom slučaju, spinovi elektrona koji formiraju valentni par moraju biti suprotni (vezu formiraju elektroni sa antiparalelnim spinovima).
2. Originalne atomske orbitale (AO) zadržavaju svoj obris u sastavu molekula.
3. Veza se formira zbog preklapanja orbitala, što dovodi do povećanja elektronske gustine između jezgara atoma u interakciji u pravcu koji obezbeđuje maksimalno preklapanje.
Razmotrimo formiranje hemijske veze duž MBC u molekulu vodene pare H2O.
Molekul se sastoji od jednog atoma kiseonika O i dva atoma vodonika H . Elektronska formula atoma kiseonika 1 s 2 2 s 2 2 p 4 . Vanjski energetski nivo sadrži 6 elektrona. Podnivo 2 s je ispunjen. Na podnivou 2 p na jednoj od str -orbitale (pod pretpostavkom p y ,) postoji elektronski par, a na druga dva ( p x i p z ) jedan nespareni elektron. Oni su ti koji će učestvovati u formiranju hemijske veze.

Elektronska formula atoma vodika 1 s 1 . Vodonik ima jednu s -elektron čiji je orbitalni obris sfera, i on će učestvovati u preklapanju sa str -kiseonička orbitala, formirajući hemijsku vezu. Ukupno ovih sp -postojat će dva preklapanja u molekulu vode. A struktura molekula će izgledati ovako:

Kao što se može vidjeti sa slike, u molekuli vode postoje dvije kovalentne hemijske veze usmjerene duž osi Z i X . Stoga je ugao veze u ovom modelu 90 O . Eksperiment pokazuje da je ovaj ugao 104,5 o.
Nije loš spoj za jednostavan model visoke kvalitete bez ikakvih proračuna!
Elektronegativnost kiseonika po Mullikenu je 3,5, a vodonika 2,1. Prema tome, svaka od veza će biti polarna, a naelektrisana - biće na kiseoniku, i
- biće na kiseoniku, i + - na vodonik, tj. Formiraju se tri centra električnog naboja. U molekuli se formiraju dva električna dipola.
+ - na vodonik, tj. Formiraju se tri centra električnog naboja. U molekuli se formiraju dva električna dipola.
Dipol su dva jednaka naboja koja se nalaze na konačnoj udaljenosti l jedno od drugog. Dipol karakterizira dipolni moment
 =
=

Dipol je vektor usmjeren od negativnog do pozitivnog pola. U molekuli vode formiraju se dva dipolna momenta veze, koji kada se saberu daju ukupni dipolni moment molekule. Dijagram dipolnih momenata molekule vode prema MBC modelu ima oblik:

Važno je naglasiti da se dipolni momenti veza zbrajaju vektorski i da ukupni dipolni moment zavisi od geometrije molekula. Kao što vidimo, u ovom slučaju, zbog činjenice da su veze usmjerene pod pravim kutom jedna prema drugoj, molekula kao cjelina ispada polarnom. I eksperiment to potvrđuje: dipolni moment molekule vode je 1,84 Debye. (1 Debye je jednako 0,33*10-29 Kl*m)
Geometrijska struktura veza u molekulima može biti vrlo raznolika. Veze se mogu nalaziti i na ravni i u prostoru, formirajući molekule u obliku volumetrijskih tijela različitih konfiguracija (trigonalne, tetragonalne, heksagonalne piramide, bipiramide, prstenovi sastavljeni od piramida, itd.)
Više o odnosu između strukture hemijskih veza i geometrije molekula možete pročitati u udžbeniku na strani 119 128).
 - (c igma) i
- (c igma) i  (pi)-veze.
(pi)-veze.
Vratimo se na preklapanje orbitala tokom formiranja veze. U našem primjerumaksimalna površina preklapanja s i p orbitale leži na liniji koja spaja centre atoma. Ova vrsta preklapanja se zove - veze.
- veze.
Razmotrimo još jedan slučaj - molekul kisika O2 . Kao što smo već vidjeli, atom kiseonika ima dva str -orbitale koje sadrže elektrone sposobne da formiraju hemijsku vezu. Dobro poznata strukturna formula kiseonika O=O . U molekulu kiseonika postoji dvostruka veza. Jedna od njih je upravo o kojoj smo govorili -veza. A drugi? Ispostavilo se da se druga veza formira zbog druge vrste orbitalnog preklapanja tzv
-veza. A drugi? Ispostavilo se da se druga veza formira zbog druge vrste orbitalnog preklapanja tzv - komunikacija.
- komunikacija.
Concept of  I
I  veze je iznio F. Hund.
veze je iznio F. Hund.
Tokom edukacije  -veze orbitala se preklapaju na način da se formiraju dvije oblasti preklapanja, koje se nalaze simetrično u odnosu na ravan na kojoj leže jezgra atoma u interakciji.
-veze orbitala se preklapaju na način da se formiraju dvije oblasti preklapanja, koje se nalaze simetrično u odnosu na ravan na kojoj leže jezgra atoma u interakciji.
Geometrijski to izgleda ovako:

Imajte na umu da - vezu formiraju manji dijelovi str -orbitale u kojima je gustina "elektronskog oblaka" veća, pa je i ova veza jača
- vezu formiraju manji dijelovi str -orbitale u kojima je gustina "elektronskog oblaka" veća, pa je i ova veza jača - veze. Zaista, eksperiment pokazuje da u jedinjenjima ugljika etan C 2 H 6 (CH 3 - CH 3 jedan
- veze. Zaista, eksperiment pokazuje da u jedinjenjima ugljika etan C 2 H 6 (CH 3 - CH 3 jedan  -veza), etilen C 2 H 4 (CH 2 = CH 2 - jedan
-veza), etilen C 2 H 4 (CH 2 = CH 2 - jedan  - komunikacija i jedan
- komunikacija i jedan  -veza) i acetilen C 2 H 2 (C HC H - jedan
-veza) i acetilen C 2 H 2 (C HC H - jedan  - komunikacija i dva
- komunikacija i dva  -veza) njihova energija prekida je 247, 419 i 515 kJ/mol.
-veza) njihova energija prekida je 247, 419 i 515 kJ/mol.
Sada možemo dodati na listu MBC postulata:
4.
Ako se u molekuli formiraju višestruke (dvostruke i trostruke) veze, tada će jedna od njih biti -komunikacija i ostalo -
-komunikacija i ostalo - - veze).
- veze).
Imajte na umu da u vezama d - i f -metali, moguće je formiranje druge vrste veze - -veze, kada se preklapanje dešava u četiri prostorna područja i ravan simetrije je okomita na liniju koja povezuje atomska jezgra.
-veze, kada se preklapanje dešava u četiri prostorna područja i ravan simetrije je okomita na liniju koja povezuje atomska jezgra.
Hibridizacija atomskih orbitala.
Kada se formiraju hemijske veze, može se desiti važan fenomen tzvorbitalna hibridizacija.
Razmotrimo atom berilija Budi . Njegova elektronska formula je 1 s 2 2 s 2 . Sudeći po činjenici da su svi elektroni berilijuma upareni, takav atom bi se trebao ponašati hemijski kao plemeniti gasovi i ne ulaziti u hemijske interakcije.
Međutim, pogledajmo pažljivo dijagram difrakcije elektrona atoma berilija:

Iz dijagrama je jasno da atom berilijuma ima, pored ispunjenih 2 s -orbitale još tri slobodne 2 str -orbitale! Istina, energija ovih orbitala je veća od energije 2 s -orbitale po veličini E . Ali ova energija je mala i manja od one koja se oslobađa tokom formiranja hemijske veze. Stoga, atom teži da preuredi svoje orbitale tokom interakcije kako bi postigao energetski povoljno konačno stanje. Za takvo restrukturiranje koristi se kinetička energija čestica koje stupaju u interakciju sa datim atomom. O ovom izvoru energije ćemo detaljnije govoriti kada budemo raspravljali o pitanjima kemijske kinetike. 5
E . Ali ova energija je mala i manja od one koja se oslobađa tokom formiranja hemijske veze. Stoga, atom teži da preuredi svoje orbitale tokom interakcije kako bi postigao energetski povoljno konačno stanje. Za takvo restrukturiranje koristi se kinetička energija čestica koje stupaju u interakciju sa datim atomom. O ovom izvoru energije ćemo detaljnije govoriti kada budemo raspravljali o pitanjima kemijske kinetike. 5
Ovo preuređenje se naziva orbitalna hibridizacija, jer tokom ovog procesa nastaje nova iz „dva tipa” orbitala.
U jeziku talasnih funkcija, ovo je opisano jednadžbom koja povezuje hibridnu talasnu funkciju rezultujućih orbitala sa originalnim talasnim funkcijama.
Broj formiranih hibridnih orbitala jednak je broju orbitala koje su učestvovale u procesu hibridizacije.
Grafički ovaj proces može biti predstavljen sljedećim dijagramom:

Imajte na umu da je energija potrebna za hibridizaciju E hibrid manje od energetske razlike između hibridizirajućih orbitala E.
Oznaka hibridnih orbitala zadržava oznaku originalnih orbitala. Dakle, u ovom slučaju (atom Budi ), hibridizuju jedan s i jedan str -orbitala, a obje hibridne orbitale su označene kao sp -orbitale. Potreba za hibridizacijom samo dvije orbitale je zbog činjenice da atom berilijuma ima samo dva elektrona na vanjskom energetskom nivou.
U drugim slučajevima, kada je nekoliko identičnih orbitala uključeno u hibridizaciju, njihov broj je označen eksponentom. Na primjer, prilikom hibridizacije jednog s i dva str -postoje tri orbitale sp 2 -orbitale, a tokom hibridizacije jednog s i tri str -orbitale četiri sp 3 orbitale.
U slučaju koji se razmatra, u skladu sa Hundovim pravilom, atom berilijuma prima dva nesparena elektrona i sposobnost formiranja dve kovalentne hemijske veze.
Formirane su hibridne orbitale s, p pa čak i d -orbitale se malo razlikuju po obliku i izgledaju ovako (“asimetrična bučica”):

Imajte na umu da je broj hibridnih orbitala jednak broju orbitala uključenih u njihovo stvaranjebez obzira na broj i tip hibridizirajućih orbitala.
Položaj hibridnih orbitala u svemiru određen je njihovim brojem.
Konkretno, atom berilijuma ima dva hibrida sp -orbitale se nalaze duž jedne prave linije (pod uglom od 180 o ), što odgovara želji slično nabijenih elektrona koji ih zauzimaju da se što više udalje jedan od drugog:

Više detalja O metodi valentnih veza i hibridizacije možete pročitati ovdje:
http://center.fio.ru/method/resources/Alikberovalyu/2004/stroenie/gl_10.html#104
Molekule često imaju orbitale zauzete elektronskim parom („usamljeni elektronski par“). Takve orbitale ne učestvuju u formiranju hemijskih veza, ali utiču na geometrijsku strukturu molekula.
Modifikacija MBC koja uzima u obzir uticaj takvih orbitala naziva se teorija odbijanja elektronskih parova valentnih orbitala (EPVO) i sa njom se možete upoznati u udžbeniku na strani 124 128.
Koncept molekularne orbitalne metode.
Ispitivali smo fenomen hibridizacije akcionarskih društava u okviru MBC-a. Pokazalo se da je ideja hibridizacije plodonosna i za dublje modeliranje hemijskih veza. To je osnova druge metode njihovog opisa, o kojoj se govori u našoj metodi kursamolekularne orbitale(MO).
Glavni postulat ove metode je tvrdnja da AO atoma koji međusobno djeluju gube svoju individualnost i formiraju generalizirane MO, tj. da elektroni u molekulima ne "pripadaju" nijednom određenom atomu, već se kreću kvantno mehanički kroz molekularnu strukturu.
Postoji nekoliko varijanti ML metode koje uzimaju u obzir b O veći ili manji broj faktora i, shodno tome, više ili manje matematički složen. Najjednostavnija aproksimacija je ona koja uzima u obzir samo linearne efekte interakcije elektrona. Ova aproksimacija se naziva MO LCAO (linearna kombinacija atomskih orbitala) metoda.
Jezikom kvantne mehanike ova izjava za najjednostavniji slučaj interakcije dviju orbitala piše se na sljedeći način:
Gdje  - MO valna funkcija,
- MO valna funkcija, - talasna funkcija AO prvog atoma,
- talasna funkcija AO prvog atoma, - talasna funkcija drugog atoma, a i b numerički koeficijenti koji karakterišu doprinos datog DD ukupnoj strukturi MO.
- talasna funkcija drugog atoma, a i b numerički koeficijenti koji karakterišu doprinos datog DD ukupnoj strukturi MO.
Pošto je linearni polinom napisan na desnoj strani, ova modifikacija MO metode naziva se LCAO.
Iz jednačine je jasno dakada dva AO interaguju, dobijaju se dva MO. Jedan od njih se zove vezivanje MO, a drugo otpuštanje MO.
Zašto su dobili takvo ime jasno je iz slike koja prikazuje energetski dijagram orbitala u molekuli:

Kao što se može vidjeti sa slike, vezujući MO ima energiju nižu od energije originalnog AO, a antivezujući MO ima veću energiju. (odnosno,). Naravno, u skladu sa principom minimalne energije, elektroni u molekulu će prvo zauzeti orbitalu veze prilikom formiranja veze.
Općenito, prilikom interakcije N AO postaje N MO.
Sigma (  ) i pi(
) i pi(  )-molekularne orbitale.
)-molekularne orbitale.
Kao rezultat kvantitativnih proračuna primjenom MO LCAO metode, pokazalo se da su koncepti I
I  tipovi orbitalne simetrije su očuvani u LCAO MO metodi.
tipovi orbitalne simetrije su očuvani u LCAO MO metodi.
Ovako izgledaju obrisi -vezujući (označen kao
-vezujući (označen kao ili) i
ili) i  -antivezujuće (označene kao ili) orbitale u LCAO MO metodi:
-antivezujuće (označene kao ili) orbitale u LCAO MO metodi:

A ovako izgledaju obrisi - povezivanje (
- povezivanje (  ) I
) I  - popuštanje (
- popuštanje (  *
) orbitale koristeći LCAO MO metodu:
*
) orbitale koristeći LCAO MO metodu:


Energetski dijagrami formiranja molekularnih orbitala za binarne homonuklearne molekule.
Izračunavanje energije molekularnih orbitala za složene molekule koje uključuju jezgra različitih elemenata (heteronuklearne molekule) je složen računski zadatak čak i za moderne računare. Stoga je svaki proračun pojedinačnih molekula poseban kreativni rad.
Ipak, pokazalo se da je energetski dijagram za binarne homonuklearne molekule elemenata drugog perioda periodnog sistema D. I. Mendeljejeva univerzalan i ima oblik:

Ponekad literatura daje različite dijagrame za elemente B ,C,N i kasnije O, F, Ne , međutim, proučavanje magnetskih svojstava molekula B 2 na ultraniskim temperaturama ne potvrđuju jasno potrebu za kompliciranjem vrste energetskih dijagrama za B,C,N.
Dia- i paramagnetski molekuli. Višestrukost priključaka prema MO LCAO.
Jedna od ozbiljnih prednosti MO LCAO metode u odnosu na BC metodu je ispravniji opis magnetskih svojstava molekula i, posebno, objašnjenje paramagnetizma molekularnog kiseonika. 6
Prisjetimo se strukture molekule kisika prema MBC-u, koju smo ranije ispitali. Prema ovoj strukturi, svi valentni elektroni i I
I  -veze u molekulu O2 formiraju elektronske parove i ukupni spin molekula je nula.
-veze u molekulu O2 formiraju elektronske parove i ukupni spin molekula je nula.
Struktura orbitala ove molekule metodom LCAO MO, dobijena punjenjem MO elektronima u skladu sa gornjim energetskim dijagramom, ima oblik:

Kao što se može vidjeti iz ovog dijagrama, molekul kisika sadrži dva nesparena elektrona na antivezi I
I  orbitale. Njihovi magnetni momenti se zbrajaju i daju ukupni magnetni moment molekula. Eksperiment pokazuje da je magnetni moment molekula kiseonika 2,8
orbitale. Njihovi magnetni momenti se zbrajaju i daju ukupni magnetni moment molekula. Eksperiment pokazuje da je magnetni moment molekula kiseonika 2,8 (Intrinzični magnetni moment elektrona 1
(Intrinzični magnetni moment elektrona 1 ). S obzirom da ukupni magnetni moment, pored sopstvenog elektronskog momenta, uključuje i orbitalni, kvantitativna koincidencija veoma uverljivo svedoči u prilog validnosti MO metode.
). S obzirom da ukupni magnetni moment, pored sopstvenog elektronskog momenta, uključuje i orbitalni, kvantitativna koincidencija veoma uverljivo svedoči u prilog validnosti MO metode.
U prisustvu magnetskog momenta, supstanca postajeparamagnetski"privučen je magnetom". 7 U nedostatku magnetnog momenta, supstanca dijamagnetski magnetno polje ga „izbacuje“.. 8
Pored magnetnih svojstava, analiza energetskih dijagrama MO LCAO omogućava određivanjevišestrukost (ili red) hemijske veze (CS ili PS).
KS= ½ (N spoj N rez)
gdje je N veza ukupan broj elektrona u orbitalama vezivanja; N bit ukupan broj elektrona u antivezujućim orbitalama).
Razmotrili smo različite slučajeve ispoljavanja i opisa kovalentnih hemijskih veza. Ovo je glavna vrsta hemijske veze, jer je razlog njenog nastanka prisustvo valentnih elektrona u velikoj većini hemijskih elemenata.
Međutim, u nekim slučajevima interakcije atoma nastaju posebni uslovi koji dovode do posebnih vrsta veza, koje ćemo razmotriti u narednom predavanju.
jednak radu koji se mora utrošiti da se molekula podijeli na dva dijela (atomi, grupe atoma) i ukloni ih jedan od drugog na beskonačnoj udaljenosti. Na primjer, ako E. x. With. H 3 C-H u molekulu metana, onda su takve čestice metil grupa CH 3 i atom vodonika H, ako se uzme u obzir E. hemija. With. H-H u molekulu vodonika, takve čestice su atomi vodonika. E. x. With. - poseban slučaj energije vezivanja (vidi Energija vezivanja) , obično se izražava u kJ/mol(kcal/mol); u zavisnosti od čestica koje formiraju hemijsku vezu (vidi Hemijska veza), prirode interakcije između njih (kovalentna veza, vodikova veza i druge vrste hemijskih veza), višestrukost veze (na primjer, dvostruke, trostruke veze) E. x. With. ima vrijednost od 8-10 do 1000 kJ/mol. Za molekul koji sadrži dvije (ili više) identičnih veza, E. ch. With. svaka veza (energija kidanja veze) i prosječna energija veze jednaka prosječnoj vrijednosti energije kidanja ovih veza. Dakle, energija kidanja HO-H veze u molekuli vode, odnosno toplotni efekat reakcije H 2 O = HO + H iznosi 495 kJ/mol, energija prekida H-O veze u hidroksilnoj grupi - 435 kJ/mol, prosječna E. x. With. jednako 465 kJ/mol. Razlika između vrijednosti energije rupture i prosječne E. ch. With. zbog činjenice da se tokom djelomične disocijacije (vidi Disocijacija) molekula (razbijanje jedne veze), mijenja elektronska konfiguracija i relativni raspored atoma preostalih u molekulu, uslijed čega se mijenja njihova energija interakcije. Vrijednost E. x. With. zavisi od početne energije molekula; ova činjenica se ponekad naziva zavisnošću E. x. With. na temperaturi. Obično E. x. With. razmatraju se za slučajeve kada su molekuli u standardnom stanju (Vidi Standardna stanja) ili na 0 K. To su ove vrijednosti E. x. With. obično se daju u priručniku. E. x. With. - važna karakteristika koja određuje reaktivnost (vidi Reaktivnost) supstance i koriste se u termodinamičkim i kinetičkim proračunima hemijskih reakcija (vidi Hemijske reakcije). E. x. With. može se indirektno odrediti iz kalorimetrijskih mjerenja (vidi Termohemija) , proračunom (vidi Kvantna hemija) , kao i korišćenjem masene spektroskopije (vidi Masenu spektroskopiju) i spektralne analize (vidi spektralnu analizu).
"Energija hemijske veze" u knjigama
17. Dužina hemijske veze
Iz knjige Hemija autor Danina Tatyana17. Dužina hemijske veze Udaljenost između hemijskih elemenata je dužina hemijske veze – veličina poznata u hemiji. Određuje se odnosom privlačnih i odbojnih sila hemikalija u interakciji
03. Energija, sila, zamah, kinetička energija, kalorijska…
Iz knjige Mehanika tijela autor Danina Tatyana03. Energija, sila, impuls, kinetička energija, kalorijska... U fizici postoji velika konfuzija vezana za upotrebu pojmova "energija", "sila", "impuls" i "kinetička energija". daleko od toga, uprkos činjenici da ova četiri koncepta postoje u fizici
Galaktička energija – energija misli
Iz knjige Zlatni anđeli autor Klimkevič Svetlana TitovnaGalaktička energija – Energija misli 543 = Galaktička energija je energija misli = “Numerički kodovi”. Knjiga 2. Kryonska hijerarhija 09/06/2011 JA SAM Ono što JESAM! JA SAM Manas! Pozdrav majstore!Šta treba da znam danas?Svetlana,draga! Moja dobra devojko! Dobro je da si ti
A energija je kosmička energija (Kundalini)
Iz knjige Anđeli autor Klimkevič Svetlana TitovnaA energija je kosmička energija (Kundalini) 617 = Samo dobro, susrećući se sa zlom i ne inficirajući se njime, pobjeđuje zlo = Izgubivši vjeru, osoba gubi sposobnost da voli = „Brojevi." Knjiga 2. Kryonska hijerarhija 04/11/14 JA JESAM KOJI JESAM!JA SAM Nebeski Otac! JA SAM Vječnost! Svetlana, ti
MAGNETNA ENERGIJA - ENERGIJA NOVIH VREMENA (KPAYON)
Iz knjige Kryon. Biram tebe. Kanaliziranje kroz Nama Ba Hala autor Kryon Nam Ba HalMAGNETNA ENERGIJA - ENERGIJA NOVOG VREMENA (KPAYON) Dragi moj prijatelju, ti si blistava Viša Svetlost, koja je jednom odlučila u ljudskom telu, da bi stekla životno iskustvo, da uroni u sablasnu stvarnost, što, strogo govoreći, čini ne postoji Ja, Kryon, pozdravljam te
Anđeo – Univerzalna energija – Energija života
Iz knjige JA SAM Vječnost. Književni razgovori sa Stvoriteljem (zbirka) autor Klimkevič Svetlana TitovnaAnđeo – Univerzalna Energija – Energija života 958 = Mnogo je stvari koje ne možete vidjeti svojim očima, morate ih vidjeti svojom dušom – to je poteškoća = “Brojevi kodova”. Knjiga 2. Kryonska hijerarhija I onaj u kome gori svjetlost razuma neće činiti loša djela u svijetu. Livije Tit (380 godina prije
SLOBODNA ENERGIJA – VEZANA ENERGIJA
Iz knjige Rječnik psihoanalize autor Laplanche JSLOBODNA ENERGIJA – VEZANA ENERGIJA Njemački: freie Energie – gebundene Energie. – francuski: energie libre – energija liee. – engleski: slobodna energija – vezana energija. – španski: energia libre – energia ligada. – talijanski::energia libera – energia legata. – portugalski: energia uvre – energia ligada. Termini koji sa ekonomske tačke gledišta podrazumevaju,
12. Energija akcije i energija obuzdavanja
Iz knjige Životni stil koji biramo autor Förster Friedrich Wilhelm12. Energija akcije i energija obuzdavanja Vežbe u energiji obuzdavanja su izuzetno važne za razvoj energije delovanja. Svako ko želi da postigne nešto konkretno mora svu svoju snagu koncentrirati na jedan cilj. Stoga se mora odlučno oduprijeti
Iz knjige NIKOLA TESLA. PREDAVANJA. ČLANCI. od Tesla NikoleENERGIJA IZ ŽIVOTNE SREDINE - VJETROMIN I SOLARNI MOTOR - POGONA ENERGIJE IZ TOPLOTE ZEMLJE - ELEKTRIČNA ENERGIJA IZ PRIRODNIH IZVORA Postoje mnoge druge tvari osim goriva koje bi mogle dati energiju. Ogromna količina energije sadržana je, na primjer, u
br. 175 Izveštaj inspektora za hemijsku pripremu Crvene armije V.N. Bataševa načelniku Glavne uprave Crvene armije S.S. Kamenev o reorganizaciji hemijskih trupa i organa hemijske službe u ratu i miru
Iz knjige Reforma u Crvenoj armiji Dokumenti i materijali 1923-1928. [Knjiga 2] autor Vojno-poslovni tim Autorski tim --br. 175 Izveštaj inspektora za hemijsku pripremu Crvene armije V.N. Bataševa načelniku Glavne uprave Crvene armije S.S. Kamenev o reorganizaciji hemijskih trupa i organa hemijske službe u ratu i miru br. 049015/ss 5. maja 1927. Sov. tajna Inspekcija hemijske pripreme smatra da je potrebno
Šta je veće: energija koja se oslobađa pri raspadu jednog jezgra uranijuma ili energija koju komarac potroši na zakrilce jednog krila?
Iz knjige Najnovija knjiga činjenica. Tom 3 [Fizika, hemija i tehnologija. Istorija i arheologija. razno] autor Kondrašov Anatolij PavlovičŠta je veće: energija koja se oslobađa pri raspadu jednog jezgra uranijuma ili energija koju komarac potroši na zakrilce jednog krila? Energija koja se oslobađa pri raspadu jednog jezgra uranijuma je reda veličine 10 triliontinih džula, a energija koju komarac potroši na jedan otkucaj krila je oko 10 triliontinih džula.
Energija komunikacije
TSBEnergija hemijske veze
Iz knjige Velika sovjetska enciklopedija (EN) autora TSBIII. Postupak povezivanja televizijskih i radijskih komunikacijskih mreža i njihova interakcija sa komunikacijskom mrežom televizijskog i radio-difuznog operatera televizijske i radio-difuzne komunikacijske mreže koja zauzima značajno mjesto
Iz knjige Komentar pravila za pružanje komunikacijskih usluga autor Sukhareva Natalia VladimirovnaIII. Postupak povezivanja televizijskih i radio-difuznih komunikacionih mreža i njihova interakcija sa komunikacijskom mrežom za televizijsko i radio-difuziju operatora komunikacione mreže za televizijsko i radio-difuziju koji zauzima značajno mjesto Komentar na stav 14. Registar se vodi u obliku koji utvrđuje Ministarstvo Informacije i komunikacije.
Seksualna energija je energija novca
Iz knjige Novac me voli. Direktan put do vašeg obilja! autor Tihonova – Ayyn SnezhanaSeksualna energija je energija novca, a moć je afrodizijak. Seks je jednak moći. Michael Hutchinson, psiholog Carl Jung, izumio je psihološki model za muškarce i žene, koji je nazvao anima i animus. Priznao je da svaki čovjek ima svoju unutrašnjost