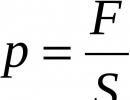Da biste odredili prirodu medija u otopini, koristite. Određivanje prirode okruženja rastvora kiselina i lužina pomoću indikatora. Kvalitativne reakcije na jone u rastvoru (hlorid, sulfat, karbonatni joni, amonijum jon). Dobijanje gasovitih materija. V
Hemijska svojstva oksida: bazični, amfoterni, kiseli
Oksidi su složene supstance koje se sastoje od dva hemijska elementa, od kojih je jedan kiseonik sa oksidacionim stanjem ($-2$).
Opšta formula oksida je: $E_(m)O_n$, gdje je $m$ broj atoma elementa $E$, a $n$ broj atoma kisika. Oksidi mogu biti teško(pijesak $SiO_2$, sorte kvarca), tečnost(vodikov oksid $H_2O$), gasoviti(ugljični oksidi: ugljični dioksid $CO_2$ i ugljični dioksid $CO$ plinovi). Na osnovu svojih hemijskih svojstava, oksidi se dijele na soli koji stvaraju i ne stvaraju soli.
Ne stvara soli To su oksidi koji ne reagiraju s alkalijama ili kiselinama i ne stvaraju soli. Malo ih je, sadrže nemetale.
Formiranje soli To su oksidi koji reagiraju s kiselinama ili bazama i stvaraju sol i vodu.
Među oksidima koji stvaraju soli postoje oksidi bazična, kisela, amfoterna.
Osnovni oksidi- to su oksidi koji odgovaraju bazama. Na primjer: $CaO$ odgovara $Ca(OH)_2, Na_2O NaOH$.
Tipične reakcije bazičnih oksida:
1. Osnovni oksid + kiselina → sol + voda (reakcija razmjene):
$CaO+2HNO_3=Ca(NO_3)_2+H_2O$.
2. Bazni oksid + kiseli oksid → sol (reakcija spojeva):
$MgO+SiO_2(→)↖(t)MgSiO_3$.
3. Bazni oksid + voda → alkalija (složena reakcija):
$K_2O+H_2O=2KOH$.
Kiseli oksidi- to su oksidi koji odgovaraju kiselinama. To su oksidi nemetala:
N2O5 odgovara $HNO_3, SO_3 - H_2SO_4, CO_2 - H_2CO_3, P_2O_5 - H_3PO_4$, kao i metalni oksidi sa visokim stepenom oksidacije: $(Cr)↖(+6)O_3$ odgovara $H_2CrO_2)↖ +7 )O_7 — HMnO_4$.
Tipične reakcije kiselog oksida:
1. Kiseli oksid + baza → sol + voda (reakcija razmjene):
$SO_2+2NaOH=Na_2SO_3+H_2O$.
2. Kiseli oksid + bazični oksid → sol (složena reakcija):
$CaO+CO_2=CaCO_3$.
3. Kiseli oksid + voda → kiselina (složena reakcija):
$N_2O_5+H_2O=2HNO_3$.
Ova reakcija je moguća samo ako je kiseli oksid topiv u vodi.
Amfoterično nazivaju se oksidi, koji, ovisno o uvjetima, pokazuju bazična ili kisela svojstva. To su $ZnO, Al_2O_3, Cr_2O_3, V_2O_5$. Amfoterni oksidi se ne spajaju direktno s vodom.
Tipične reakcije amfoternih oksida:
1. Amfoterni oksid + kiselina → sol + voda (reakcija razmjene):
$ZnO+2HCl=ZnCl_2+H_2O$.
2. Amfoterni oksid + baza → sol + voda ili kompleksno jedinjenje:
$Al_2O_3+2NaOH+3H_2O(=2Na,)↙(\text"natrijum tetrahidroksoaluminat")$
$Al_2O_3+2NaOH=(2NaAlO_2)↙(\text"natrijum aluminat")+H_2O$.
Ovisno o tome koji su ioni H + ili OH - u višku u vodenoj otopini, razlikuju se sljedeće vrste (karakteristike) medija za otopinu:
1) kiselo
2) alkalni
3) neutralan
At kisele prirode životne sredine rastvor sadrži višak vodonikovih katjona H +, a koncentracija hidroksidnih jona je blizu nule.
At alkalnom okruženju postoji višak hidroksidnih jona OH - u otopini, a koncentracija H + kationa je blizu nule.
At neutralno okruženje rastvora, koncentracije H + i OH - jona su međusobno jednake i praktično jednake nuli (0,0000001 mol/l).
Postoje neke organske tvari čija se boja mijenja ovisno o prirodi okoliša. Ovaj fenomen se široko koristi u hemiji. Neki od najčešćih indikatora su lakmus, fenolftalein i metilnarandža (metilnarandžasta). Boja ovih supstanci u zavisnosti od prirode okoline prikazana je u sledećoj tabeli:
boja indikatora |
|||
indikator |
u neutralnom okruženju |
u kiseloj sredini |
u alkalnoj sredini |
| lakmus | ljubičasta | crvena
|
plava
|
| fenolftalein | bezbojan | bezbojan | grimizno
|
| metil narandžasta (metilnarandžasta) |
narandžasta
|
roze
|
žuta
|
Kao što vidite, specifično svojstvo fenolftaleina je da ovaj indikator ne dopušta razlikovanje neutralnog i kiselog okruženja - u oba okruženja nije ni na koji način obojen. Ovo svojstvo je nesumnjivo nedostatak, ali fenolftalein se široko koristi zbog svoje izuzetne osjetljivosti čak i na neznatni višak OH - jona.
Očigledno, pomoću indikatora možete razlikovati kiseline, lužine i destilovanu vodu jedni od drugih. Međutim, treba imati na umu da se kisela, alkalna i neutralna sredina mogu uočiti ne samo u otopinama kiselina, lužina i destilirane vode. Okruženje rastvora takođe može biti različito u rastvorima soli u zavisnosti od njihovog odnosa prema hidrolizi.
Na primjer, otopina natrijevog sulfita može se razlikovati od otopine natrijevog sulfata pomoću fenolftaleina. Natrijum sulfit je so koju formiraju jaka baza i slaba kiselina, pa će njeni rastvori imati alkalnu reakciju. Fenolftalein će postati grimiz u svom rastvoru. Natrijum sulfat nastaje od jake baze i jake kiseline, tj. ne podliježe hidrolizi, a njegove vodene otopine će imati neutralnu reakciju. U slučaju rastvora natrijum sulfata, fenolftalein će ostati bezbojan.
U zadatku 18 OGE iz hemije pokazujemo poznavanje indikatora i pH, kao i kvalitativne reakcije na jone u rastvoru.
Teorija za zadatak br. 18 OGE iz hemije
Indikatori
Indikator je hemijska supstanca koja menja boju u zavisnosti od pH okoline.
Najpoznatiji indikatori su fenolftalein, metilnarandža, lakmus i univerzalni indikator. Njihove boje u zavisnosti od okruženja na slici ispod:
A evo boja indikatora detaljnije sa primjerima iz stvarnog života:

Bavili smo se indikatorima; pređimo na kvalitativne reakcije na jone.
Kvalitativne reakcije na jone
Kvalitativne reakcije na katione i anjone prikazane su u tabeli ispod.

Kako se pravilno nositi sa zadatkom 18 na OGE testu iz hemije?
Da biste to učinili, morate odabrati kvalitativnu reakciju na jednu od ponuđenih opcija i osigurati da ovaj reagens ne reagira s drugom tvari.
Analiza tipičnih opcija za zadatak br. 18 OGE iz hemije
Prva verzija zadatka
Uspostavite korespondenciju između dvije supstance i reagensa koji se može koristiti za razlikovanje ovih supstanci.
Supstance:
A) Na2CO3 i Na2SiO3
B) K2CO3 i Li2CO3
B) Na2SO4 i NaOH
reagens:
1) CuCl2
4) K3PO4
Hajde da razmotrimo svaki slučaj.
Na2CO3 i Na2SiO3
- reakcija sa bakrenim hloridom ne dolazi u oba slučaja, jer se bakar karbonat i silikat razlažu u vodenom rastvoru
- sa hlorovodoničnom kiselinom, u slučaju natrijum karbonata, oslobađa se gas, a u slučaju silikata nastaje talog - to je kvalitativna reakcija na silikate
- sa fosfatom takođe nema kvalitativnih reakcija na natrijum
K2CO3 i Li2CO3
- Ove tvari ne reagiraju s bakrenim kloridom (u stvari, taloži se talog bakrenog hidroksida, ali ova reakcija ne može razlikovati dva reagensa)
- Oba reagiraju sa hlorovodoničnom kiselinom i oslobađaju ugljični dioksid.
- Ove tvari ne reagiraju s magnezijevim oksidom, a magnezijev oksid ne ulazi u reakcije ionske izmjene
- sa fosfatom litijum se taloži kao fosfat , ali bez kalijuma
Ostala nam je posljednja opcija - bakar hlorid. Doista, bakar hidroksid precipitira s natrijum hidroksidom, ali reakcija se ne događa sa sulfatom.
Lekcija koju je vodio I.I.Novoshinskaya, N.S. Novoshinskaya za 8. razred u opštinskoj obrazovnoj ustanovi „Srednja škola br ).
Svrha časa: Formiranje, konsolidacija i kontrola umijeća učenika u određivanju reakcije okruženja pomoću različitih indikatora, uključujući i prirodne, koristeći svesku za praktičan rad I.I.Novoshinskaya za udžbenik Hemija 8.
Ciljevi lekcije:
- Obrazovni. Učvrstiti sljedeće pojmove: indikatori, reakcija medija (vrste), pH, filtrat, filtracija na osnovu izvođenja praktičnih radnih zadataka. Provjeriti znanje učenika koje odražava odnos “rastvor tvari (formula) – pH vrijednost (brojčana vrijednost) – reakcija medija”. Recite učenicima o načinima smanjenja kiselosti tla u regiji Arkhangelsk.
- Razvojni. Podsticati razvoj logičkog mišljenja učenika na osnovu analize rezultata dobijenih tokom praktičnog rada, njihovog uopštavanja, kao i sposobnosti izvođenja zaključaka. Potvrdite pravilo: praksa dokazuje ili opovrgava teoriju. Nastaviti sa formiranjem estetskih kvaliteta ličnosti učenika na osnovu raznovrsnosti predstavljenih rešenja, kao i podržati interesovanje dece za predmet „Hemija“ koji se izučava.
- Obrazovanje. Nastaviti razvijati vještine učenika u obavljanju praktičnih radnih zadataka, pridržavanju pravila o zaštiti zdravlja i sigurnosti na radu, uključujući pravilno izvođenje procesa filtriranja i grijanja.
Praktični rad br. 6 “Određivanje pH sredine.”
Cilj za učenike: Naučiti da određuju reakciju okoline na rastvore različitih objekata (kiseline, lužine, soli, rastvori zemljišta, nekih rastvora i sokova), kao i proučavanje biljnih objekata kao prirodnih indikatora.
Oprema i reagensi: stalak sa epruvetama, čep, staklena šipka, stalak sa prstenom, filter papir, makaze, hemijski levak, čaše, porculanski malter i tučak, fino rende, čisti pesak, univerzalni indikator papir, test rastvor, zemlja, prokuhana voda , voće, bobičasto voće i drugi biljni materijal, rastvor natrijum hidroksida i sumporne kiseline, natrijum hlorid.
Napredak lekcije
Momci! Već smo se upoznali s takvim konceptima kao što su reakcija medija vodenih otopina, kao i indikatori.
Koje vrste reakcija u vodenim rastvorima poznajete?
- neutralna, alkalna i kisela.
Šta su indikatori?
- tvari koje se mogu koristiti za određivanje reakcije okoline.
Koje indikatore znate?
- u rastvorima: fenolftalein, lakmus, metil narandža.
- suho: univerzalni indikator papir, lakmus papir, metil narandžasti papir
Kako možete odrediti reakciju vodenih otopina?
- mokro i suho.
Koliki je pH okoline?
- pH vrijednost vodikovih jona u otopini (pH=– log)
Prisjetimo se koji je naučnik uveo koncept pH?
- Danski hemičar Sorensen.
bravo!!! Sada otvorite svesku za praktični rad na str. 21 i pročitajte zadatak br.
Zadatak br. 1. Odredite pH rastvora pomoću univerzalnog indikatora.
Prisjetimo se pravila pri radu sa kiselinama i alkalijama!
Dovršite eksperiment iz zadatka br. 1.
Izvucite zaključak. Dakle, ako otopina ima pH = 7 okolina je neutralna, na pH< 7 среда кислотная, при pH >7 alkalna sredina.
Zadatak br. 2. Dobiti otopinu tla i odrediti pH pomoću univerzalnog indikatora.
Pročitajte zadatak na str. 21-22, izvršite zadatak prema planu, unesite rezultate u tabelu.
Prisjetimo se sigurnosnih pravila pri radu s uređajima za grijanje (alkoholna peć).
Šta je filtriranje?
- proces odvajanja mješavine, koji se zasniva na različitoj propusnosti poroznog materijala – filtrata u odnosu na čestice koje čine smjesu.
Šta je filtrat?
- Ovo je bistra otopina dobivena nakon filtracije.
Rezultate predstaviti u obliku tabele.
Kakva je reakcija okoline zemljišnog rastvora?
- Kiselo
Šta je potrebno učiniti da bi se poboljšao kvalitet zemljišta u našem regionu?
- CaCO 3 + H 2 O + CO 2 = Ca(HCO 3) 2
Primjena gnojiva koja imaju alkalnu reakciju okoline: mljeveni krečnjak i drugi karbonatni minerali: kreda, dolomit. U okrugu Pinezhsky u regiji Arkhangelsk nalaze se nalazišta takvog minerala kao što je krečnjak u blizini kraških pećina, tako da je dostupan.
Izvucite zaključak. Reakcija dobivene otopine tla je pH = 4, blago kisela, stoga je potrebno vapnenje za poboljšanje kvalitete tla.
Zadatak br. 3. Odredite pH nekih otopina i sokova pomoću univerzalnog indikatora.
Pročitajte zadatak na str. 22, izvršite zadatak prema algoritmu, unesite rezultate u tabelu.
Izvor soka |
Izvor soka |
||
Krompir |
Silikatno ljepilo |
||
Svježi kupus |
Stono sirće |
||
Kiseli kupus |
Rastvor sode bikarbone |
||
Narandžasta |
|||
Svježa repa |
|||
Kuvana cvekla |
Izvucite zaključak. Dakle, različiti prirodni objekti imaju različite pH vrednosti: pH 1–7 – kisela sredina (limun, brusnica, narandža, paradajz, cvekla, kivi, jabuka, banana, čaj, krompir, kiseli kupus, kafa, silikatni lepak).
pH 7–14 alkalna sredina (svježi kupus, rastvor sode bikarbone).
pH = 7 neutralna sredina (persimmon, krastavac, mlijeko).
Zadatak br. 4. Istražite indikatore biljaka.
Koji biljni objekti mogu biti indikatori?
- bobičasto voće: sokovi, latice cvijeća: ekstrakti, sokovi povrća: korijenje, lišće.
- tvari koje mogu promijeniti boju otopine u različitim sredinama.
Pročitajte zadatak na str. 23 i izvršite ga prema planu.
Rezultate predstaviti u tabeli.
Biljni materijal (prirodni pokazatelji) |
Prirodni indikator boje rastvora |
||
Kiselo okruženje |
Prirodna boja rastvora (neutralno okruženje) |
Alkalna sredina |
|
brusnica (sok) |
ljubičasta |
||
jagoda (sok) |
narandžasta |
breskvasto ružičasta |
|
borovnica (sok) |
crveno-ljubičasta |
plavo-ljubičasta |
|
crna ribizla (sok) |
crveno-ljubičasta |
plavo-ljubičasta |
|
Izvucite zaključak. Tako, u zavisnosti od pH sredine, prirodni pokazatelji: brusnice (sok), jagode (sok), borovnice (sok), crna ribizla (sok) dobijaju sledeće boje: u kiseloj sredini - crvena i narandžasta, u neutralnoj okruženje - crvena, breskva – roze i ljubičaste boje, u alkalnoj sredini od roze preko plavo-ljubičaste do ljubičaste.
Shodno tome, intenzitet boje prirodnog indikatora može se ocijeniti reakcijom medija određene otopine.
Kada završite, sredite svoj radni prostor.
Momci! Danas je bila veoma neobična lekcija! Da li vam se svidelo?! Mogu li se informacije naučene u ovoj lekciji koristiti u svakodnevnom životu?
Sada dovršite zadatak dat u svojim sveskama za vježbanje.
Kontrolni zadatak. Rasporedite supstance čije su formule date u nastavku u grupe u zavisnosti od pH vrednosti njihovih rastvora: HCl, H 2 O, H 2 SO 4, Ca (OH) 2, NaCl, NaOH, KNO 3, H 3 PO 4, KOH.
pH 17 – okolina (kisela), imaju rastvore (HCl, H 3 PO 4, H 2 SO 4).
pH 714 okolina (alkalna), imaju rastvore (Ca(OH) 2, KOH, NaOH).
pH = 7 okolina (neutralno), imaju rastvore (NaCl, H 2 O, KNO 3).
Evaluacija za rad_______________
Hemijski, pH otopine se može odrediti pomoću acido-baznih indikatora.
Kiselo-bazni indikatori su organske supstance čija boja zavisi od kiselosti sredine.
Najčešći indikatori su lakmus, metilnarandža i fenolftalein. Lakmus postaje crven u kiseloj sredini i plavi u alkalnoj sredini. Fenolftalein je bezbojan u kiseloj sredini, ali postaje grimiz u alkalnoj sredini. Metilnarandžasta postaje crvena u kiseloj sredini, a žuta u alkalnoj.
U laboratorijskoj praksi često se miješaju brojni indikatori, odabrani tako da se boja smjese mijenja u širokom rasponu pH vrijednosti. Uz njihovu pomoć možete odrediti pH otopine s točnošću od jedan. Ove mješavine se nazivaju univerzalni indikatori.
Postoje posebni uređaji - pH metri, pomoću kojih možete odrediti pH otopine u rasponu od 0 do 14 s točnošću od 0,01 pH jedinica.
Hidroliza soli
Kada se neke soli otapaju u vodi, ravnoteža procesa disocijacije vode se narušava i, shodno tome, mijenja se pH okoline. To je zato što soli reaguju sa vodom.
Hidroliza soli – kemijska izmjenjivačka interakcija otopljenih iona soli s vodom, što dovodi do stvaranja slabo disocirajućih proizvoda (molekula slabih kiselina ili baza, anjona kiselih soli ili kationa bazičnih soli) i praćeno promjenom pH medija.
Razmotrimo proces hidrolize u zavisnosti od prirode baza i kiselina koje formiraju so.
Soli formirane od jakih kiselina i jakih baza (NaCl, kno3, Na2so4, itd.).
recimo da kada natrijum hlorid reaguje s vodom, dolazi do reakcije hidrolize da nastane kiselina i baza:
NaCl + H 2 O ↔ NaOH + HCl
Za ispravno razumijevanje prirode ove interakcije, napišimo jednačinu reakcije u ionskom obliku, uzimajući u obzir da je jedino jedinjenje koje se slabo disocira u ovom sistemu voda:
Na + + Cl - + HOH ↔ Na + + OH - + H + + Cl -
Kada se ponište identični joni na lijevoj i desnoj strani jednačine, jednačina disocijacije vode ostaje:
H 2 O ↔ H + + OH -
Kao što vidite, u rastvoru nema viška H + ili OH - jona u odnosu na njihov sadržaj u vodi. Osim toga, ne stvaraju se nikakva druga slabo disocirajuća ili teško rastvorljiva jedinjenja. Iz ovoga zaključujemo da soli koje formiraju jake kiseline i baze ne podležu hidrolizi, a reakcija rastvora ovih soli je ista kao u vodi, neutralna (pH = 7).
Prilikom sastavljanja ionsko-molekularnih jednadžbi za reakcije hidrolize potrebno je:
1) zapišite jednačinu disocijacije soli;
2) odrediti prirodu katjona i anjona (naći katjon slabe baze ili anjon slabe kiseline);
3) zapišite jonsko-molekularnu jednačinu reakcije, vodeći računa da je voda slab elektrolit i da zbir naelektrisanja treba da bude isti na obe strane jednačine.
Soli koje formiraju slaba kiselina i jaka baza
(Na 2 CO 3 , K 2 S,CH 3 COONa I itd. .)
Razmotrite reakciju hidrolize natrijum acetata. Ova sol u rastvoru se razlaže na ione: CH 3 COONa ↔ CH 3 COO - + Na + ;
Na + je kation jake baze, CH 3 COO - je anjon slabe kiseline.
Kationi Na+ ne mogu vezati vodene ione, jer se NaOH, jaka baza, potpuno raspada na ione. Anjoni slabe octene kiseline CH 3 COO - vezuju vodikove ione da bi formirali blago disociranu octenu kiselinu:
CH 3 COO - + HON ↔ CH 3 COOH + OH -
Vidi se da je kao rezultat hidrolize CH 3 COONa u rastvoru nastao višak hidroksidnih jona, a reakcija medijuma je postala alkalna (pH > 7).
Tako možemo zaključiti da soli koje formiraju slaba kiselina i jaka baza hidroliziraju na anionu ( An n - ). U ovom slučaju, anjoni soli vezuju H ione + , a OH joni se akumuliraju u otopini - , što uzrokuje alkalno okruženje (pH>7):
An n - + HOH ↔ Han (n -1)- + OH - , (pri n=1 nastaje HAn – slaba kiselina).
Hidroliza soli formiranih od dvo- i trobaznih slabih kiselina i jakih baza odvija se postupno
Razmotrimo hidrolizu kalijum sulfida. K 2 S disocira u rastvoru:
K 2 S ↔ 2K + + S 2- ;
K+ je kation jake baze, S2 je anjon slabe kiseline.
Kationi kalija ne učestvuju u reakciji hidrolize samo slabi hidrosulfidni anioni. U ovoj reakciji, prvi korak je formiranje slabo disocirajućih HS - jona, a drugi korak je formiranje slabe kiseline H 2 S:
1. stupanj: S 2- + HOH ↔ HS - + OH - ;
2. faza: HS - + HOH ↔ H 2 S + OH - .
Joni OH koji nastaju u prvoj fazi hidrolize značajno smanjuju vjerovatnoću hidrolize u sljedećoj fazi. Kao rezultat toga, obično je od praktične važnosti proces koji se javlja samo u prvoj fazi, koji je po pravilu ograničen na procjenu hidrolize soli u normalnim uvjetima.