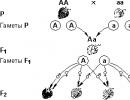
Hemijska veza u molekulu fluora je jonska. Vrste hemijskih veza. Kovalentna hemijska veza
Hemijski preparat za rak i DPA
Sveobuhvatno izdanje
DIO I
OPĆA HEMIJA
HEMIJA ELEMENATA
HALOGENI
Jednostavne supstance
Hemijska svojstva fluora
Fluor je najjači oksidant u prirodi. Ne reaguje direktno samo sa helijumom, neonom i argonom.
U reakciji sa metalima nastaju fluoridi, jonska jedinjenja:
Fluor snažno reaguje sa mnogim nemetalima, čak i sa nekim inertnim gasovima:

Hemijska svojstva hlora. Interakcija sa složenim supstancama
Klor je jači oksidant od broma ili joda, tako da hlor istiskuje teške halogene iz njihovih soli:
![]()
Otapajući se u vodi, hlor djelomično reagira s njom, što rezultira stvaranjem dvije kiseline: klorida i hipoklorita. U ovom slučaju, jedan atom klora povećava oksidacijsko stanje, a drugi ga smanjuje. Takve reakcije se nazivaju reakcije disproporcionalnosti. Reakcije disproporcionalnosti su reakcije samoizlječenja-samooksidacije, tj. reakcije u kojima jedan element pokazuje svojstva i oksidatora i redukcionog agensa. Prilikom disproporcioniranja istovremeno nastaju spojevi u kojima je element u oksidiranom i redukovanijem stanju u odnosu na izvorni. Oksidacijsko stanje atoma klora u molekuli hipokloritne kiseline je +1:
Interakcija hlora sa alkalnim rastvorima se odvija na sličan način. U tom slučaju nastaju dvije soli: hlorid i hipohlorit.
Klor stupa u interakciju s različitim oksidima:
![]()
Klor oksidira neke soli u kojima metal nije u svom maksimalnom oksidacijskom stanju:
Molekularni hlor reaguje sa mnogim organskim jedinjenjima. U prisustvu ferum(III) hlorida kao katalizatora, hlor reaguje sa benzenom i nastaje hlorobenzen, a kada se ozrači svetlom, ista reakcija dovodi do stvaranja heksahlorcikloheksana:

Hemijska svojstva brom i jod
Obje tvari reagiraju s vodikom, fluorom i alkalijama:

Jod se oksidira raznim jakim oksidantima:
Metode ekstrakcije jednostavnih supstanci
Ekstrakcija fluora
Budući da je fluor najjači kemijski oksidator, nemoguće ga je izolirati kemijskim reakcijama iz spojeva u slobodnom obliku, pa se fluor ekstrahira fizičko-hemijskom metodom - elektrolizom.
Za ekstrakciju fluora koriste se taline kalijum fluorida i elektrode od nikla. Nikl se koristi zbog činjenice da je metalna površina pasivizirana fluorom zbog stvaranja nerastvorljivih
NiF2, dakle, same elektrode nisu uništene tvari koja se na njima oslobađa:Ekstrakcija hlora
Klor se proizvodi u industrijskim razmjerima elektrolizom otopine natrijevog klorida. Kao rezultat ovog procesa, također se proizvodi natrijum hidroksid:
U br velike količine Klor se proizvodi oksidacijom otopine klorovodika različitim metodama:

Klor je veoma važan proizvod hemijske industrije.
Njegova globalna proizvodnja iznosi milione tona.
Ekstrakti broma i joda
Za industrijsku upotrebu, brom i jod se dobijaju oksidacijom bromida, odnosno jodida. Za oksidaciju se najčešće koriste molekularni klor, koncentrirana sulfatna kiselina ili mangan dioksid:

Fluor i neki od njegovih spojeva koriste se kao oksidator za raketno gorivo. Velike količine fluora se koriste za ekstrakciju različitih rashladnih sredstava (freona) i nekih polimera koji se odlikuju hemijskom i termičkom otpornošću (teflon i neki drugi). Fluor se koristi u nuklearnoj tehnologiji za odvajanje izotopa uranijuma.
Većina hlora se koristi za proizvodnju hlorovodonične kiseline, a takođe i kao oksidaciono sredstvo za proizvodnju drugih halogena. U industriji se koristi za izbjeljivanje tkanina i papira. U većim količinama od fluora koristi se za proizvodnju polimera (PVC i drugih) i rashladnih sredstava. Hlor se koristi za dezinfekciju vode za piće. Takođe je potreban za ekstrakciju određenih rastvarača, kao što su hloroform, metilen hlorid i ugljik tetrahlorid. Također se koristi za proizvodnju mnogih supstanci, kao što su kalijev hlorat (Bertholletova so), izbeljivač i mnoga druga jedinjenja koja sadrže atome hlora.
Brom i jod se u industriji ne koriste u istom obimu kao klor ili fluor, ali se upotreba ovih supstanci povećava svake godine. Brom se koristi u proizvodnji raznih sedativnih lijekova. Jod se koristi u proizvodnji antiseptičkih lijekova. Jedinjenja broma i joda se široko koriste u kvantitativnoj analizi supstanci. Neki metali se pročišćavaju uz pomoć joda (ovaj proces se naziva rafiniranje joda), kao što su titan, vanadij i drugi.
Atom, molekula, nuklearna svojstva
Struktura atoma fluora.
U središtu atoma nalazi se pozitivno nabijeno jezgro. Okolo se vrti 9 negativno nabijenih elektrona.
Elektronska formula: 1s2;2s2;2p5
m prot. = 1,00783 (amu)
m neutral.= 1,00866 (a.m.u.)
m proton = m elektron
Izotopi fluora.
Izotop: 18F
kratak opis: Prevalencija u prirodi: 0%
Broj protona u jezgru je 9. Broj neutrona u jezgru je 9. Broj nukleona je 18.E veze = 931,5(9*m pr.+9*m neutron-M(F18)) = 138,24 (MEV)E specifičan = E veze/N nukleoni = 7,81 (MEV/nukleon)
Alfa raspad je nemoguć Beta minus raspad je nemoguć Raspad pozitrona: F(Z=9,M=18)-->O(Z=8,M=18)+e(Z=+1,M=0)+0.28( MeV) Hvatanje elektrona: F(Z=9,M=18)+e(Z=-1,M=0)-->O(Z=8,M=18)+1,21(MeV)
Izotop: 19F
Kratke karakteristike: Prevalencija u prirodi: 100%
Molekul fluora.
Slobodni fluor se sastoji od dvoatomskih molekula. Sa hemijske tačke gledišta, fluor se može okarakterisati kao monovalentni nemetal, i, štaviše, najaktivniji od svih nemetala. To je zbog brojnih razloga, uključujući lakoću razgradnje molekula F2 na pojedinačne atome - energija potrebna za to je samo 159 kJ/mol (nasuprot 493 kJ/mol za O2 i 242 kJ/mol za C12). Atomi fluora imaju značajan afinitet prema elektronima i relativno male veličine. Stoga se ispostavlja da su njihove valentne veze s atomima drugih elemenata jače od sličnih veza drugih metaloida (na primjer, energija H-F veze je - 564 kJ/mol naspram 460 kJ/mol za H-O vezu i 431 kJ/mol za H-C1 veza).
F-F komunikacija karakterizira nuklearna udaljenost od 1,42 A. Za termičku disocijaciju fluora proračunom su dobijeni sljedeći podaci:
Temperatura, °C 300 500 700 900 1100 1300 1500 1700
Stepen disocijacije, % 5 10-3 0,3 4,2 22 60 88 97 99
Atom fluora u svom osnovnom stanju ima strukturu vanjskog elektronskog sloja 2s22p5 i monovalentan je. Pobuđivanje trovalentnog stanja povezano s prijenosom jednog 2p elektrona na nivo 3s zahtijeva trošak od 1225 kJ/mol i praktično se ne ostvaruje. Elektronski afinitet neutralnog atoma fluora procjenjuje se na 339 kJ/mol. F-jon karakteriše efektivni radijus od 1,33 A i energija hidratacije od 485 kJ/mol. Kovalentni radijus fluora se obično uzima kao 71 pm (tj. polovina međunuklearne udaljenosti u molekulu F2).
Hemijska svojstva fluora.
Budući da su derivati fluora metaloidnih elemenata obično vrlo isparljivi, njihovo stvaranje ne štiti površinu metaloida od daljeg djelovanja fluora. Stoga je interakcija često mnogo energičnija nego kod mnogih metala. Na primjer, silicijum, fosfor i sumpor se zapale u plinu fluora. Slično se ponaša i amorfni ugljen (ugljen), dok grafit reaguje samo na crvenu toplotu. Fluor se ne kombinuje direktno sa azotom i kiseonikom.
Fluor uklanja vodonik iz vodoničnih spojeva drugih elemenata. Većina oksida se njime razgrađuje, istiskujući kisik. Konkretno, voda interaguje prema šemi F2 + H2O --> 2 HF + O
Štaviše, istisnuti atomi kiseonika se ne kombinuju samo jedni s drugima, već delimično i sa molekulima vode i fluora. Stoga, osim plina kisika, ova reakcija uvijek proizvodi vodikov peroksid i fluor oksid (F2O). Potonji je blijedožuti plin sličan mirisu ozonu.
Fluor oksid (inače poznat kao kiseonik fluorid - OF2) može se dobiti propuštanjem fluora u 0,5 N. rastvor NaOH. Reakcija se odvija prema jednadžbi: 2 F2 + 2 NaOH = 2 NaF + H2O + F2O Sljedeće reakcije su također karakteristične za fluor:
H2 + F2 = 2HF (sa eksplozijom)
Teme Kodifikator jedinstvenog državnog ispita: Kovalentna hemijska veza, njene vrste i mehanizmi nastanka. Karakteristike kovalentna veza(polaritet i energija vezivanja). Jonska veza. Metalni priključak. Vodikova veza
Intramolekularne hemijske veze
Prvo, pogledajmo veze koje nastaju između čestica unutar molekula. Takve veze se nazivaju intramolekularno.
Hemijska veza između atoma hemijski elementi ima elektrostatičku prirodu i nastaje zbog interakcija vanjskih (valentnih) elektrona, u manjem ili većem stepenu drže pozitivno nabijena jezgra vezanih atoma.
Ključni koncept je ovdje ELEKTRONEGATIVNOST. Ona je ta koja određuje tip hemijska veza između atoma i svojstva ove veze.
je sposobnost atoma da privuče (zadrži) vanjski(valencija) elektrona. Elektronegativnost je određena stepenom privlačenja spoljašnjih elektrona na jezgro i zavisi prvenstveno od radijusa atoma i naelektrisanja jezgra.
Elektronegativnost je teško jednoznačno odrediti. L. Pauling je sastavio tabelu relativnih elektronegativnosti (zasnovanu na energijama veza dvoatomskih molekula). Najelektronegativniji element je fluor sa značenjem 4 .
Važno je napomenuti da u različitim izvorima možete pronaći različite skale i tablice vrijednosti elektronegativnosti. Ovo ne treba biti uznemireno, jer formiranje hemijske veze igra ulogu atoma, a približno je isto u svakom sistemu.
Ako jedan od atoma u kemijskoj vezi A:B jače privlači elektrone, tada se elektronski par kreće prema njemu. Više razlika u elektronegativnosti atoma, što se elektronski par više pomera.
Ako su elektronegativnosti atoma u interakciji jednake ili približno jednake: EO(A)≈EO(B), tada se zajednički elektronski par ne pomiče ni na jedan od atoma: A: B. Ova veza se zove kovalentna nepolarna.
Ako se elektronegativnosti atoma u interakciji razlikuju, ali ne mnogo (razlika u elektronegativnosti je otprilike od 0,4 do 2: 0,4<ΔЭО<2 ), tada se elektronski par pomiče na jedan od atoma. Ova veza se zove kovalentna polarna .
Ako se elektronegativnosti atoma u interakciji značajno razlikuju (razlika u elektronegativnosti je veća od 2: ΔEO>2), tada se jedan od elektrona gotovo potpuno prenosi na drugi atom, sa formiranjem joni. Ova veza se zove jonski.
Osnovni tipovi hemijskih veza − kovalentna, jonski I metal komunikacije. Pogledajmo ih pobliže.
Kovalentna hemijska veza
Kovalentna veza – to je hemijska veza , nastala zbog formiranje zajedničkog elektronskog para A:B . Štaviše, dva atoma preklapanje atomske orbitale. Kovalentna veza nastaje interakcijom atoma s malom razlikom u elektronegativnosti (obično između dva nemetala) ili atoma jednog elementa.
Osnovna svojstva kovalentnih veza
- fokus,
- zasićenost,
- polaritet,
- polarizabilnost.
Ova svojstva vezivanja utiču na hemijska i fizička svojstva supstanci.
Smjer komunikacije karakteriše hemijsku strukturu i oblik supstanci. Uglovi između dvije veze nazivaju se uglovi veze. Na primjer, u molekuli vode vezni ugao H-O-H je 104,45 o, stoga je molekul vode polarni, a u molekuli metana vezni ugao H-C-H je 108 o 28′.
Zasićenost je sposobnost atoma da formiraju ograničen broj kovalentnih hemijskih veza. Broj veza koji atom može formirati naziva se.
Polaritet veza nastaje zbog neravnomjerne raspodjele elektronske gustoće između dva atoma različite elektronegativnosti. Kovalentne veze dijele se na polarne i nepolarne.
Polarizabilnost veze su sposobnost veznih elektrona da se pomjeraju pod utjecajem vanjskog električnog polja(posebno, električno polje druge čestice). Polarizabilnost zavisi od pokretljivosti elektrona. Što je elektron udaljeniji od jezgre, to je pokretniji, a samim tim i molekul je više polarizabilan.
Kovalentna nepolarna hemijska veza
Postoje 2 vrste kovalentne veze - POLAR I NON-POLARNI .
Primjer . Razmotrimo strukturu molekule vodonika H2. Svaki atom vodonika na svom vanjskom energetskom nivou nosi 1 nespareni elektron. Za prikaz atoma koristimo Lewisovu strukturu - ovo je dijagram strukture vanjskog energetskog nivoa atoma, kada su elektroni označeni tačkama. Modeli Lewisove tačke strukture su od velike pomoći kada se radi sa elementima drugog perioda.
H. + . H = H:H
Dakle, molekul vodonika ima jedan zajednički elektronski par i jednu H–H hemijsku vezu. Ovaj elektronski par se ne pomera ni na jedan od atoma vodika, jer Atomi vodika imaju istu elektronegativnost. Ova veza se zove kovalentna nepolarna .
Kovalentna nepolarna (simetrična) veza je kovalentna veza koju formiraju atomi sa jednakom elektronegativnošću (obično isti nemetali) i, prema tome, sa ravnomernom raspodelom elektronske gustine između jezgara atoma.
Dipolni moment nepolarnih veza je 0.
Primjeri: H 2 (H-H), O 2 (O=O), S 8.
Kovalentna polarna hemijska veza
Kovalentna polarna veza je kovalentna veza koja se javlja između atomi različite elektronegativnosti (obično, raznih nemetala) i karakteriziran je pomak dijeli elektronski par na elektronegativniji atom (polarizacija).
Gustoća elektrona se pomjera na elektronegativniji atom - stoga se na njemu pojavljuje djelomični negativni naboj (δ-), a na manje elektronegativnom atomu pojavljuje se djelomični pozitivni naboj (δ+, delta +).
Što je veća razlika u elektronegativnosti atoma, to je veća polaritet veze i drugo dipolni moment . Između susjednih molekula i naboja suprotnog predznaka djeluju dodatne privlačne sile, koje se povećavaju snagu komunikacije.
Polaritet veze utiče na fizička i hemijska svojstva jedinjenja. Mehanizmi reakcije, pa čak i reaktivnost susjednih veza zavise od polariteta veze. Polaritet veze često određuje polaritet molekula i na taj način direktno utiče na fizička svojstva kao što su tačka ključanja i tačka topljenja, rastvorljivost u polarnim rastvaračima.
primjeri: HCl, CO 2, NH 3.
Mehanizmi stvaranja kovalentne veze
Kovalentne hemijske veze mogu nastati pomoću 2 mehanizma:
1. Mehanizam razmjene formiranje kovalentne hemijske veze je kada svaka čestica daje jedan nespareni elektron da formira zajednički elektronski par:
A . + . B= A:B
2. Formiranje kovalentne veze je mehanizam u kojem jedna od čestica daje usamljeni par elektrona, a druga čestica osigurava praznu orbitalu za ovaj elektronski par:
O: + B= A:B
U ovom slučaju, jedan od atoma daje usamljeni par elektrona ( donator), a drugi atom daje praznu orbitalu za taj par ( akceptor). Kao rezultat formiranja obje veze, energija elektrona se smanjuje, tj. ovo je korisno za atome.
Kovalentna veza formirana mehanizmom donor-akceptor nije drugačije u svojstvima drugih kovalentnih veza formiranih mehanizmom razmjene. Formiranje kovalentne veze mehanizmom donor-akceptor tipično je za atome ili s velikim brojem elektrona na vanjskom energetskom nivou (donori elektrona), ili, obrnuto, s vrlo malim brojem elektrona (akceptori elektrona). Valentne sposobnosti atoma su detaljnije razmotrene u odgovarajućem odjeljku.
Kovalentnu vezu formira mehanizam donor-akceptor:
- u molekulu ugljen monoksid CO(veza u molekulu je trostruka, 2 veze se formiraju mehanizmom razmene, jedna donor-akceptorskim mehanizmom): C≡O;
- V amonijum jona NH 4 +, u jonima organski amini, na primjer, u metilamonijum jonu CH 3 -NH 2 + ;
- V kompleksna jedinjenja, hemijska veza između centralnog atoma i ligandnih grupa, na primer, u natrijum tetrahidroksoaluminatu Na veza između aluminijuma i hidroksidnih jona;
- V dušične kiseline i njenih soli- nitrati: HNO 3, NaNO 3, u nekim drugim azotnim jedinjenjima;
- u molekulu ozona O3.
Osnovne karakteristike kovalentnih veza
Kovalentne veze se obično formiraju između atoma nemetala. Glavne karakteristike kovalentne veze su dužina, energija, višestrukost i usmjerenost.
Višestrukost hemijske veze
Višestrukost hemijske veze - Ovo broj zajedničkih elektronskih parova između dva atoma u spoju. Višestrukost veze može se prilično lako odrediti iz vrijednosti atoma koji formiraju molekulu.
Na primjer , u molekulu vodonika H 2 višestrukost veze je 1, jer Svaki vodonik ima samo 1 nespareni elektron na svom vanjskom energetskom nivou, stoga se formira jedan zajednički elektronski par.
U molekuli kiseonika O 2, multiplicitet veze je 2, jer Svaki atom na vanjskom energetskom nivou ima 2 nesparena elektrona: O=O.
U molekulu azota N2, multiplicitet veze je 3, jer između svakog atoma postoje 3 nesparena elektrona na vanjskom energetskom nivou, a atomi formiraju 3 zajednička elektronska para N≡N.
Dužina kovalentne veze
Dužina hemijske veze
je udaljenost između centara jezgara atoma koji formiraju vezu. Određuje se eksperimentalnim fizičkim metodama. Dužina veze može se približno procijeniti korištenjem pravila aditivnosti, prema kojem je dužina veze u molekuli AB približno jednaka polovini sume dužina veze u molekulima A 2 i B 2: 
Dužina hemijske veze može se grubo proceniti atomskim radijusima formiranje veze, ili po komunikacijskoj višestrukosti, ako radijusi atoma nisu mnogo različiti.
Kako se radijusi atoma koji formiraju vezu povećavaju, dužina veze će se povećavati.
Na primjer
Kako se povećava broj veza između atoma (čiji se atomski radijusi ne razlikuju ili se razlikuju samo malo), duljina veze će se smanjiti.
Na primjer . U nizu: C–C, C=C, C≡C, dužina veze se smanjuje.
Energija komunikacije
Mjera snage hemijske veze je energija veze. Energija komunikacije određena energijom potrebnom za prekid veze i uklanjanje atoma koji formiraju tu vezu na beskonačno veliku udaljenost jedan od drugog.
Kovalentna veza je veoma izdržljiv. Njegova energija se kreće od nekoliko desetina do nekoliko stotina kJ/mol. Što je energija veze veća, to je veća snaga veze i obrnuto.
Jačina hemijske veze zavisi od dužine veze, polariteta veze i višestrukosti veze. Što je hemijska veza duža, to je lakše prekinuti, a što je manja energija veze, to je manja njena snaga. Što je hemijska veza kraća, to je jača i veća je energija veze.
Na primjer, u nizu jedinjenja HF, HCl, HBr s leva na desno, jačina hemijske veze smanjuje se, jer Dužina veze se povećava.
Jonska hemijska veza
Jonska veza je hemijska veza zasnovana na elektrostatičko privlačenje jona.
Joni nastaju u procesu prihvatanja ili doniranja elektrona od strane atoma. Na primjer, atomi svih metala slabo drže elektrone sa vanjskog energetskog nivoa. Zbog toga se atomi metala odlikuju obnavljajuća svojstva- sposobnost doniranja elektrona.
Primjer. Atom natrijuma sadrži 1 elektron na energetskom nivou 3. Lako ga se odričući, atom natrija formira mnogo stabilniji Na + jon, sa elektronskom konfiguracijom plemenitog gasa neona Ne. Natrijum jon sadrži 11 protona i samo 10 elektrona, tako da je ukupni naboj jona -10+11 = +1:
+11N / A) 2 ) 8 ) 1 - 1e = +11 N / A +) 2 ) 8
Primjer. Atom hlora na svom vanjskom energetskom nivou sadrži 7 elektrona. Da bi stekao konfiguraciju stabilnog inertnog atoma argona Ar, klor treba da dobije 1 elektron. Nakon dodavanja elektrona, formira se stabilan jon hlora koji se sastoji od elektrona. Ukupan naboj jona je -1:
+17Cl) 2 ) 8 ) 7 + 1e = +17 Cl — ) 2 ) 8 ) 8
Bilješka:
- Svojstva jona se razlikuju od svojstava atoma!
- Ne samo da se mogu formirati stabilni joni atomi, ali takođe grupe atoma. Na primjer: amonijum jon NH 4 +, sulfatni jon SO 4 2-, itd. Hemijske veze formirane od takvih jona takođe se smatraju jonskim;
- Jonske veze se obično formiraju jedna između druge metali I nemetali(nemetalne grupe);
Nastali ioni se privlače zbog električne privlačnosti: Na + Cl -, Na 2 + SO 4 2-.
Hajde da vizuelno sumiramo razlika između tipa kovalentne i jonske veze:
Metalna hemijska veza
Metalni priključak je veza koja se formira relativno slobodnih elektrona između metalni joni, formirajući kristalnu rešetku.
Atomi metala se obično nalaze na vanjskom energetskom nivou jedan do tri elektrona. Radijusi atoma metala su, u pravilu, veliki - dakle, atomi metala, za razliku od nemetala, prilično lako odustaju od svojih vanjskih elektrona, tj. su jaki redukcioni agensi
Intermolekularne interakcije
Zasebno, vrijedno je razmotriti interakcije koje nastaju između pojedinačnih molekula u tvari - intermolekularne interakcije . Intermolekularne interakcije su vrsta interakcije između neutralnih atoma u kojoj se ne pojavljuju nove kovalentne veze. Sile interakcije između molekula otkrio je Van der Waals 1869. godine i dobio ime po njemu. Van dar Waalsove snage. Van der Waalsove snage se dijele na orijentacija, indukcija I disperzivno . Energija međumolekularnih interakcija je mnogo manja od energije hemijskih veza.
Orijentacijske sile privlačenja nastaju između polarnih molekula (dipol-dipol interakcija). Ove sile se javljaju između polarnih molekula. Induktivne interakcije je interakcija između polarnog i nepolarnog molekula. Nepolarna molekula je polarizirana zbog djelovanja polarnog, što stvara dodatnu elektrostatičku privlačnost.
Posebna vrsta međumolekularne interakcije su vodikove veze. - to su intermolekularne (ili intramolekularne) hemijske veze koje nastaju između molekula koje imaju visoko polarne kovalentne veze - H-F, H-O ili H-N. Ako postoje takve veze u molekulu, onda će ih postojati između molekula dodatne privlačne sile .
Obrazovni mehanizam vodonična veza je dijelom elektrostatička, a dijelom donorsko-akceptorna. U ovom slučaju, donor elektronskog para je atom jako elektronegativnog elementa (F, O, N), a akceptor su atomi vodika povezani sa ovim atomima. Vodikove veze karakteriziraju fokus u svemiru i saturation
Vodikove veze mogu se označiti tačkama: H ··· O. Što je veća elektronegativnost atoma spojenog na vodonik, i što je manja njegova veličina, to je jača vodikova veza. Tipičan je prvenstveno za veze fluor sa vodonikom , kao i do kiseonik i vodonik , manje azot sa vodonikom .
Vodikove veze nastaju između sljedećih supstanci:
— fluorovodonik HF(gas, rastvor fluorovodonika u vodi - fluorovodonična kiselina), vode H 2 O (para, led, tečna voda):
— rastvor amonijaka i organskih amina- između molekula amonijaka i vode;
— organska jedinjenja u kojima se vezuju O-H ili N-H: alkoholi, karboksilne kiseline, amini, aminokiseline, fenoli, anilin i njegovi derivati, proteini, rastvori ugljenih hidrata - monosaharidi i disaharidi.
Vodikova veza utiče na fizička i hemijska svojstva supstanci. Dakle, dodatno privlačenje između molekula otežava ključanje tvari. Supstance sa vodoničnim vezama pokazuju abnormalno povećanje tačke ključanja.
Na primjer U pravilu, s povećanjem molekularne težine, uočava se povećanje točke ključanja tvari. Međutim, u nizu supstanci H 2 O-H 2 S-H 2 Se-H 2 Te ne uočavamo linearnu promjenu u tačkama ključanja.
Naime, kod tačka ključanja vode je nenormalno visoka - ne manje od -61 o C, kako nam pokazuje prava linija, ali mnogo više, +100 o C. Ova anomalija se objašnjava prisustvom vodoničnih veza između molekula vode. Dakle, u normalnim uslovima (0-20 o C) voda je tečnost po faznom stanju.
(prvi elektron)
(prema Paulingu)
| F | 9 |
| 18,9984 | |
| 2s 2 2p 5 | |
| Fluor | |
Hemijska svojstva
Najaktivniji nemetal, nasilno stupa u interakciju s gotovo svim tvarima (rijetki iznimci su fluoroplastika), a s većinom njih - sa izgaranjem i eksplozijom. Kontakt fluora sa vodonikom dovodi do paljenja i eksplozije čak i na veoma niskim temperaturama (do -252°C). Čak i voda i platina:uranijum za nuklearnu industriju gore u atmosferi fluora.
klor trifluorid ClF 3 - sredstvo za fluoriranje i moćan oksidant raketnog goriva
sumpor heksafluorid SF 6 - plinoviti izolator u elektroindustriji
metalni fluoridi (kao što su W i V), koji imaju neka korisna svojstva
freoni su dobra rashladna sredstva
teflon - hemijski inertni polimeri
natrijum heksafluoroaluminat - za naknadnu proizvodnju aluminijuma elektrolizom
razna jedinjenja fluora
Raketarija
Jedinjenja fluora se široko koriste u raketnoj tehnologiji kao oksidatori za raketno gorivo.Primjena u medicini
Jedinjenja fluora se široko koriste u medicini kao zamjene za krv.
Biološka i fiziološka uloga
Fluor je vitalni element za tijelo. U ljudskom tijelu, fluor se uglavnom nalazi u zubnoj caklini u sastavu fluorapatita - Ca 5 F (PO 4) 3. Uz nedovoljnu (manje od 0,5 mg/litar vode za piće) ili prekomjernu (više od 1 mg/litar) konzumacije fluorida, u tijelu se mogu razviti zubne bolesti: karijes i fluoroza (pjegavost cakline), odnosno osteosarkom.
Za prevenciju karijesa preporučuje se upotreba pasta za zube sa fluoridnim aditivima ili pijenje fluorisane vode (do koncentracije od 1 mg/l), ili lokalne aplikacije 1-2% rastvora natrijum fluorida ili kalaj fluorida. Takve radnje mogu smanjiti vjerovatnoću karijesa za 30-50%.
Maksimalno dozvoljena koncentracija vezanog fluora u vazduhu industrijskih prostorija je 0,0005 mg/litar.
Dodatne informacije
Fluor, Fluorum, F(9)
Fluor (Fluor, Francuski i Njemački Fluor) je u slobodnom stanju dobijen 1886. godine, ali su njegovi spojevi odavno poznati i široko se koriste u metalurgiji i proizvodnji stakla. Prvi spomen fluorita (CaP) pod imenom fluorit (Fliisspat) datira iz 16. stoljeća. U jednom od djela koje se pripisuje legendarnom Vasiliju Valentinu spominje se kamenje obojeno u razne boje - fluks (Fliisse od latinskog fluere - teći, sipati), koje se koristilo kao fluks pri topljenju metala. O tome pišu Agricola i Libavius. Potonji uvodi posebne nazive za ovaj fluks - fluorspar (Flusspat) i mineralni fluor. Mnogi autori hemijskih i tehničkih dela 17. i 18. veka. opisati različite vrste fluorita. U Rusiji se ovo kamenje zvalo fin, spalt, spat; Lomonosov je ovo kamenje klasifikovao kao selenite i nazvao ih spar ili fluks (kristalni fluks). Ruski zanatlije, kao i kolekcionari mineralnih kolekcija (na primjer, u 18. stoljeću, knez P.F. Golitsyn) znali su da neke vrste šparta kada se zagriju (na primjer, u vrućoj vodi) svijetle u mraku. Međutim, Leibniz, u svojoj istoriji fosfora (1710), spominje termofosfor (termofosfor) u vezi s tim.
Očigledno, hemičari i hemičari zanatlije upoznali su se sa fluorovodoničnom kiselinom najkasnije u 17. veku. Godine 1670., nirnberški zanatlija Schwanhard koristio je fluorit pomiješan sa sumpornom kiselinom za urezivanje uzoraka na staklenim peharima. Međutim, u to vrijeme priroda fluorita i fluorovodonične kiseline bila je potpuno nepoznata. Vjerovalo se, na primjer, da silicijumska kiselina ima efekat kiseljenja u Schwanhardovom procesu. Ovo pogrešno mišljenje eliminirao je Scheele, koji je dokazao da kada fluorit reaguje sa sumpornom kiselinom, silicijumska kiselina nastaje kao rezultat korozije staklene retorte nastalom fluorovodoničnom kiselinom. Osim toga, Scheele je ustanovio (1771.) da je fluorit kombinacija vapnenačke zemlje sa posebnom kiselinom, koja je nazvana “švedska kiselina”.
Lavoisier je prepoznao radikal fluorovodonične kiseline kao jednostavno tijelo i uključio ga u svoju tablicu jednostavnih tijela. Fluorovodonična kiselina je dobijena u manje-više čistom obliku 1809. godine. Gay-Lussac i Thénard destilacijom fluorita sa sumpornom kiselinom u olovnoj ili srebrnoj retorti. Tokom ove operacije, oba istraživača su otrovana. Pravu prirodu fluorovodonične kiseline ustanovio je 1810. Ampere. On je odbacio Lavoisierovo mišljenje da fluorovodonična kiselina treba da sadrži kiseonik i dokazao analogiju ove kiseline sa hlorovodoničnom kiselinom. Ampere je prijavio svoja otkrića Davyju, koji je nedavno ustanovio elementarnu prirodu hlora. Davy se u potpunosti složio s Ampereovim argumentima i uložio je mnogo truda u dobivanje slobodnog fluora elektrolizom fluorovodonične kiseline i na druge načine. Uzimajući u obzir snažan korozivni učinak fluorovodonične kiseline na staklo, kao i na biljna i životinjska tkiva, Ampere je predložio da se element koji se u njemu nalazi nazove fluorom (grčki - uništenje, smrt, kuga, kuga itd.). Međutim, Davy nije prihvatio ovo ime i predložio je drugi - Fluorine, po analogiji s tadašnjim imenom hlora - Chlorine, oba naziva se još uvijek koriste u engleskom jeziku. U ruskom jeziku sačuvano je ime koje je dao Ampere.
Brojni pokušaji da se izoluje slobodni fluor u 19. veku. nije dovela do uspješnih rezultata. Tek 1886. Moissan je to uspio i dobiti slobodan fluor u obliku žuto-zelenog plina. Budući da je fluor neobično agresivan plin, Moissan je morao savladati mnoge poteškoće prije nego što je pronašao materijal pogodan za opremu u eksperimentima s fluorom. U-cijev za elektrolizu fluorovodonične kiseline na 55°C (hlađena tekućim metil hloridom) izrađena je od platine sa fluoričnim čepovima. Nakon što su proučavane hemijske i fizičke osobine slobodnog fluora, našao je široku primenu. Sada je fluor jedna od najvažnijih komponenti u sintezi širokog spektra organofluornih supstanci. U ruskoj književnosti ranog 19. veka. fluor se zvao drugačije: baza fluorovodonične kiseline, fluor (Dvigubsky, 1824), fluor (Iovsky), fluor (Shcheglov, 1830), fluor, fluor, fluor. Hes je uveo naziv fluor 1831.
Rad sadrži zadatke o hemijskim vezama.
Pugačeva Elena Vladimirovna
Opis razvoja
6. Kovalentna nepolarna veza je karakteristična za
1) Cl 2 2) SO3 3) CO 4) SiO 2
1) NH 3 2) Cu 3) H 2 S 4) I 2
3) jonski 4) metal
15. Tri zajednička elektronska para formiraju kovalentnu vezu u molekulu
16. Vodikove veze nastaju između molekula
1) HI 2) HCl 3) HF 4) HBr
1) voda i dijamant 2) vodonik i hlor 3) bakar i azot 4) brom i metan
19. Vodikova veza nije tipično za supstancu
1) fluor 2) hlor 3) brom 4) jod
1)SF 4 2)CCl 4 3)CBr 4 4)CI 4
1) 1 2) 2 3) 3 4) 4
1) 1 2) 2 3) 3 4) 4
32. Atomi hemijskih elemenata drugog perioda periodnog sistema D.I. Mendeljejev formiraju jedinjenja sa jonskim hemijskim vezama sastava 1) LiF 2) CO 2 3) Al 2 O 3 4) BaS
1) jonski 2) metal
43. Jonsku vezu formiraju 1) H i S 2) P i C1 3) Cs i Br 4) Si i F
prilikom interakcije
1) jonski 2) metal
1) jonski 2) metal
NAZIV SUPSTANCE VRSTA KOMUNIKACIJE
1) cink A) jonski
2) azot B) metal
62. Utakmica
KOMUNIKACIJSKI TIP VEZE
1) jonski A) H 2
2) metal B) Va
3) kovalentna polarna B) HF
66. Najjača hemijska veza se javlja u molekuli 1) F 2 2) Cl 2 3) O 2 4) N 2
67. Jačina veze se povećava u nizu 1) Cl 2 -O 2 -N 2 2) O 2 - N 2- Cl 2 3) O 2 - Cl 2 -N 2 4) Cl 2 -N 2 -O 2
68. Navedite seriju koju karakteriše povećanje dužine hemijske veze
1) O 2 , N 2 , F 2 , Cl 2 2) N 2 , O 2 , F 2 , Cl 2 3) F 2 , N 2 , O 2 , Cl 2 4) N 2 , O 2 , Cl 2 , F 2

Pogledajmo zadatak br. 3 iz opcija Jedinstvenog državnog ispita za 2016. godinu.
Zadaci sa rješenjima.
Zadatak br. 1.
Jedinjenja sa kovalentnom nepolarnom vezom nalaze se u nizu:
1. O2, Cl2, H2
2. HCl, N2, F2
3. O3, P4, H2O
4.NH3, S8, NaF
Objašnjenje: moramo pronaći niz u kojem će postojati samo jednostavne tvari, budući da se kovalentna nepolarna veza formira samo između atoma istog elementa. Tačan odgovor je 1.
Zadatak br. 2.
Supstance s kovalentnim polarnim vezama navedene su u sljedećem nizu:
1. CaF2, Na2S, N2
2. P4, FeCl2, NH3
3. SiF4, HF, H2S
4. NaCl, Li2O, SO2
Objašnjenje: ovdje morate pronaći niz u kojem su samo složene tvari i, osim toga, svi nemetali. Tačan odgovor je 3.
Zadatak br. 3.
Vodikova veza je karakteristična za
1. Alkanov 2. Arenov 3. Alkoholi 4. Alkinov
Objašnjenje: Vodikova veza nastaje između vodikovog iona i elektronegativnog iona. Među navedenima samo alkoholi imaju takav set.
Tačan odgovor je 3.
Zadatak br. 4.
Hemijska veza između molekula vode
1. Vodonik
2. Jonski
3. Kovalentni polarni
4. Kovalentni nepolarni
Objašnjenje: Između O i H atoma u vodi formira se polarna kovalentna veza, jer su to dva nemetala, ali postoji vodikova veza između molekula vode. Tačan odgovor je 1.
Zadatak br. 5.
Svaka od dvije supstance ima samo kovalentne veze:
1. CaO i C3H6
2. NaNO3 i CO
3. N2 i K2S
4. CH4 i SiO2
Objašnjenje: veze se moraju sastojati samo od nemetala, tj tačan odgovor je 4.
Zadatak br. 6.
Supstanca s polarnom kovalentnom vezom je
1. O3 2. NaBr 3. NH3 4. MgCl2
Objašnjenje: Između atoma različitih nemetala formira se polarna kovalentna veza. Tačan odgovor je 3.
Zadatak br. 7.
Nepolarna kovalentna veza je karakteristična za svaku od dvije supstance:
1. Voda i dijamant
2. Vodonik i hlor
3. Bakar i azot
4. Brom i metan
Objašnjenje: nepolarna kovalentna veza je karakteristična za vezu atoma istog nemetalnog elementa. Tačan odgovor je 2.
Zadatak br. 8.
Koja hemijska veza nastaje između atoma elemenata sa atomskim brojevima 9 i 19?
1. Jonski
2. Metal
3. Kovalentni polarni
4. Kovalentni nepolarni
Objašnjenje: to su elementi - fluor i kalij, odnosno nemetal i metal, između takvih elemenata može se formirati samo ionska veza. Tačan odgovor je 1.
Zadatak br. 9.
Supstanca s ionskim tipom veze odgovara formuli
1. NH3 2. HBr 3. CCl4 4. KCl
Objašnjenje: formira se jonska veza između atoma metala i atoma nemetala, tj tačan odgovor je 4.
Zadatak br. 10.
Hlorovodonik i
1. Amonijak
2. Brom
3. Natrijum hlorid
4. Magnezijum oksid
Objašnjenje: Klorovodik ima kovalentnu polarnu vezu, odnosno moramo pronaći tvar koja se sastoji od dva različita nemetala - ovo je amonijak.
Tačan odgovor je 1.
Zadaci za samostalno rješavanje.
1. Vodikove veze nastaju između molekula
1. Fluorovodonična kiselina
2. Metan hlorid
3. Dimetil etar
4. Etilen
2. Jedinjenje sa kovalentnom vezom odgovara formuli
1. Na2O 2. MgCl2 3. CaBr2 4. HF
3. Supstanca sa kovalentnom nepolarnom vezom ima formulu
1. H2O 2. Br2 3. CH4 4. N2O5
4. Supstanca sa jonskom vezom je
1. CaF2 2. Cl2 3. NH3 4. SO2
5. Vodikove veze nastaju između molekula
1. Metanol
3. Acetilen
4. Metil format
6. Kovalentna nepolarna veza je karakteristična za svaku od dvije supstance:
1. Azot i ozon
2. Voda i amonijak
3. Bakar i azot
4. Brom i metan
7. Kovalentna polarna veza je karakteristična za supstancu
1. KI 2. CaO 3. Na2S 4. CH4
8. Kovalentna nepolarna veza je karakteristična za
1. I2 2. NE 3. CO 4. SiO2
9. Supstanca sa polarnom kovalentnom vezom je
1. Cl2 2. NaBr 3. H2S 4. MgCl2
10. Kovalentna nepolarna veza je karakteristična za svaku od dvije supstance:
1. Vodonik i hlor
2. Voda i dijamant
3. Bakar i azot
4. Brom i metan
Ova bilješka koristi zadatke iz zbirke Jedinstvenog državnog ispita 2016. koju je uredio A.A. Kaverina.
A4 Hemijska veza.
Hemijska veza: kovalentna (polarna i nepolarna), jonska, metalna, vodonik. Metode formiranja kovalentnih veza. Karakteristike kovalentne veze: dužina i energija veze. Formiranje jonske veze.
Opcija 1 – 1,5,9,13,17,21,25,29,33,37,41,45,49,53,57,61,65
Opcija 2 – 2,6,10,14,18,22,26,30,34,38,42,46,50,54,58,62,66
Opcija 3 – 3,7,11,15,19,23,27,31,35,39,43,47,51,55,59,63,67
Opcija 4 – 4,8,12,16,20,24,28,32,36,40,44,48,52,56,60,64,68
1. U amonijaku i barijum hloridu, hemijska veza je respektivno
1) jonski i kovalentni polarni
2) kovalentno polarni i jonski
3) kovalentne nepolarne i metalne
4) kovalentne nepolarne i jonske
2. Supstance sa samo ionskim vezama navedene su u sljedećem nizu:
1) F 2, CCl 4, KCl 2) NaBr, Na 2 O, KI 3) SO 2 .P 4 .CaF 2 4) H 2 S, Br 2, K 2 S
3. Jedinjenje sa jonskom vezom nastaje interakcijom
1) CH 4 i O 2 2) SO 3 i H 2 O 3) C 2 H 6 i HNO 3 4) NH 3 i HCI
4. U kojem nizu sve tvari imaju polarnu kovalentnu vezu?
1) HCl,NaCl,Cl 2 2) O 2,H2O,CO2 3) H2O,NH3,CH4 4) NaBr,HBr,CO
5. U kojem nizu su upisane formule supstanci sa samo polarnom kovalentnom vezom?
1) Cl 2, NO 2, HCl 2) HBr,NO,Br 2 3) H 2 S,H 2 O,Se 4) HI,H2O,PH 3
6. Kovalentna nepolarna veza je karakteristična za
1) Cl 2 2) SO3 3) CO 4) SiO 2
7. Supstanca sa polarnom kovalentnom vezom je
1) C1 2 2) NaBr 3) H 2 S 4) MgCl 2
8. Supstanca sa kovalentnom vezom je
1) CaCl 2 2) MgS 3) H 2 S 4) NaBr
9. Supstanca sa kovalentnom nepolarnom vezom ima formulu
1) NH 3 2) Cu 3) H 2 S 4) I 2
10. Supstance sa nepolarnim kovalentnim vezama su
11. Hemijska veza se formira između atoma iste elektronegativnosti
1) jonski 2) kovalentni polarni 3) kovalentni nepolarni 4) vodonik
12. Kovalentne polarne veze su karakteristične za
1) KCl 2) HBr 3) P 4 4) CaCl 2
13. Hemijski element u atomu čiji su elektroni raspoređeni između slojeva na sljedeći način: 2, 8, 8, 2 formira hemijsku vezu sa vodonikom
1) kovalentno polarni 2) kovalentni nepolarni
3) jonski 4) metal
14. U molekulu koje tvari veza između atoma ugljika ima najveću dužinu?
1) acetilen 2) etan 3) eten 4) benzen
15. Tri zajednička elektronska para formiraju kovalentnu vezu u molekulu
1) azot 2) vodonik sulfid 3) metan 4) hlor
16. Vodikove veze nastaju između molekula
1) dimetil etar 2) metanol 3) etilen 4) etil acetat
17. Polaritet veze je najizraženiji u molekulu
1) HI 2) HCl 3) HF 4) HBr
18. Supstance sa nepolarnim kovalentnim vezama su
1) voda i dijamant 2) vodonik i hlor 3) bakar i azot 4) brom i metan
19. Vodikova veza nije tipično za supstancu
1) H 2 O 2) CH 4 3) NH 3 4) CH3OH
20. Kovalentna polarna veza je karakteristična za svaku od dvije supstance čije su formule
1) KI i H 2 O 2) CO 2 i K 2 O 3) H 2 S i Na 2 S 4) CS 2 i PC1 5
21. Najslabija hemijska veza u molekulu
22. Koja supstanca ima najdužu hemijsku vezu u svom molekulu?
1) fluor 2) hlor 3) brom 4) jod
23. Svaka od supstanci navedenih u nizu ima kovalentne veze:
1) C 4 H 10, NO 2, NaCl 2) CO, CuO, CH 3 Cl 3) BaS, C 6 H 6, H 2 4) C 6 H 5 NO 2, F 2, CCl 4
24. Svaka od supstanci navedenih u nizu ima kovalentnu vezu:
1) CaO, C 3 H 6, S 8 2) Fe, NaNO 3, CO 3) N 2, CuCO 3, K 2 S 4) C 6 H 5 N0 2, SO 2, CHC1 3
25. Svaka od supstanci navedenih u nizu ima kovalentnu vezu:
1) C 3 H 4, NO, Na 2 O 2) CO, CH 3 C1, PBr 3 3) P 2 Oz, NaHSO 4, Cu 4) C 6 H 5 NO 2, NaF, CCl 4
26. Svaka od supstanci navedenih u nizu ima kovalentne veze:
1) C 3 H a, NO 2, NaF 2) KCl, CH 3 Cl, C 6 H 12 0 6 3) P 2 O 5, NaHSO 4, Ba 4) C 2 H 5 NH 2, P 4, CH 3 OH
27. Polaritet veze je najizraženiji kod molekula
1) vodonik sulfid 2) hlor 3) fosfin 4) hlorovodonik
28. U molekulu koje supstance su hemijske veze najjače?
1)SF 4 2)CCl 4 3)CBr 4 4)CI 4
29. Među supstancama NH 4 Cl, CsCl, NaNO 3, PH 3, HNO 3 - jednak je broj jedinjenja sa jonskim vezama
1) 1 2) 2 3) 3 4) 4
30. Među supstancama (NH 4) 2 SO 4, Na 2 SO 4, CaI 2, I 2, CO 2 - broj jedinjenja sa kovalentnom vezom je jednak
1) 1 2) 2 3) 3 4) 4
31. U supstancama koje nastaju spajanjem identičnih atoma, hemijska veza
1) jonski 2) kovalentni polarni 3) vodonik 4) kovalentni nepolarni
32. Atomi hemijskih elemenata drugog perioda periodnog sistema D.I. Mendeljejev formiraju jedinjenja sa jonskim hemijskim vezama sastava 1) LiF 2) CO 2 3) Al 2 O 3 4) BaS
33. Jedinjenja sa kovalentnom polarnom i kovalentnom nepolarnom vezom su, respektivno, 1) voda i vodonik sulfid 2) kalijum bromid i azot 3) amonijak i vodonik 4) kiseonik i metan
34. Kovalentne nepolarne veze su karakteristične za 1) vodu 2) amonijak 3) azot 4) metan
35. Hemijska veza u molekulu fluorovodonika
1) kovalentno polarni 3) ionski
2) kovalentni nepolarni 4) vodonik
36. Odaberite par supstanci u kojem su sve veze kovalentne:
1) NaCl, HCl 2) CO 2, BaO 3) CH 3 Cl, CH 3 Na 4) SO 2, NO 2
37. U kalijum jodidu hemijska veza
1) kovalentni nepolarni 3) metalni
2) kovalentno polarni 4) jonski
38. U ugljen-disulfidu CS 2 hemijska veza
1) jonski 2) metal
3) kovalentno polarni 4) kovalentni nepolarni
39. Kovalentna nepolarna veza se ostvaruje u jedinjenju
1) CrO 3 2) P 2 O 5 3) SO 2 4) F 2
40. Supstanca sa kovalentnom polarnom vezom ima formulu 1) KCl 2) HBr 3) P 4 4) CaCl 2
41. Jedinjenje sa ionskom hemijskom vezom
1) fosfor hlorid 2) kalijum bromid 3) azot oksid (II) 4) barijum
42. U amonijaku i barijum hloridu, hemijska veza je respektivno
1) jonski i kovalentni polarni 2) kovalentni polarni i jonski
3) kovalentne nepolarne i metalne 4) kovalentne nepolarne i jonske
43. Jonsku vezu formiraju 1) H i S 2) P i C1 3) Cs i Br 4) Si i F
44. Koja je vrsta veze u molekulu H2?
1) Jonski 2) Vodik 3) Kovalentni nepolarni 4) Donor-akceptor
45. Supstance sa kovalentnom polarnom vezom su
1) sumporov oksid (IV) 2) kiseonik 3) kalcijum hidrid 4) dijamant
46. U molekulu fluora postoji hemijska veza
1) kovalentni polarni 2) jonski 3) kovalentni nepolarni 4) vodonik
47. Koja serija navodi supstance sa samo kovalentnim polarnim vezama:
1) CH 4 H 2 Cl 2 2) NH 3 HBr CO 2 3) PCl 3 KCl CCl 4 4) H 2 S SO 2 LiF
48. U kojem nizu sve tvari imaju polarnu kovalentnu vezu?
1) HCl, NaCl, Cl 2 2) O 2 H 2 O, CO 2 3) H 2 O, NH 3, CH 4 4) KBr, HBr, CO
49. Koja serija navodi supstance sa samo jonskim vezama:
1) F 2 O LiF SF 4 2) PCl 3 NaCl CO 2 3) KF Li 2 O BaCl 2 4) CaF 2 CH 4 CCl 4
50. Nastaje spoj sa jonskom vezom prilikom interakcije
1) CH 4 i O 2 2) NH 3 i HCl 3) C 2 H 6 i HNO 3 4) SO 3 i H 2 O
51. Vodikova veza nastaje između molekula 1) etana 2) benzena 3) vodonika 4) etanola
52. Koja supstanca ima vodonične veze? 1) Vodonik sulfid 2) Led 3) Vodonik bromid 4) Benzen
53. Veza formirana između elemenata sa serijskim brojevima 15 i 53
1) jonski 2) metal
3) kovalentni nepolarni 4) kovalentni polarni
54. Veza formirana između elemenata sa serijskim brojevima 16 i 20
1) jonski 2) metal
3) kovalentni polarni 4) vodonik
55. Veza nastaje između atoma elemenata sa rednim brojevima 11 i 17
1) metalni 2) jonski 3) kovalentni 4) donor-akceptor
56. Vodikove veze nastaju između molekula
1) vodonik 2) formaldehid 3) sirćetna kiselina 4) vodonik sulfid
57. U kojoj su seriji zapisane formule supstanci sa samo polarnom kovalentnom vezom?
1) Cl 2, NH 3, HCl 2) HBr, NO, Br 2 3) H 2 S, H 2 O, S 8 4) HI, H 2 O, PH 3
58.Koja supstanca sadrži i jonske i kovalentne hemijske veze?
1) Natrijum hlorid 2) Hlorovodonik 3) Natrijum sulfat 4) Fosforna kiselina
59. Hemijska veza u molekulu ima izraženiji jonski karakter
1) litijum bromid 2) bakar hlorid 3) kalcijum karbid 4) kalijum fluorid
60. U kojoj su tvari sve kemijske veze kovalentne nepolarne?
1) Dijamant 2) Ugljenmonoksid (IV) 3) Zlato 4) Metan
61. Uspostavite korespondenciju između supstance i vrste veze atoma u ovoj supstanci.
NAZIV SUPSTANCE VRSTA KOMUNIKACIJE
1) cink A) jonski
2) azot B) metal
3) amonijak B) kovalentno polarni
4) kalcijum hlorid D) kovalentni nepolarni
62. Utakmica
KOMUNIKACIJSKI TIP VEZE
1) jonski A) H 2
2) metal B) Va
3) kovalentna polarna B) HF
4) kovalentni nepolarni D) BaF 2
63. U kom spoju je kovalentna veza između atoma nastala donor-akceptorskim mehanizmom? 1) KCl 2) CCl 4 3) NH 4 Cl 4) CaCl 2
64. Navedite molekul u kojem je energija veze najveća: 1) N≡N 2) H-H 3) O=O 4) H-F
65. Navedite molekul u kojem je hemijska veza najjača: 1) HF 2) HCl 3) HBr 4) HI