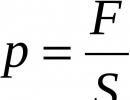Najveće oksidaciono stanje 2. Kako odrediti oksidaciono stanje atoma hemijskog elementa. Primjeri određivanja oksidacijskog stanja
Hemijski element u jedinjenju, izračunat iz pretpostavke da su sve veze jonske.
Oksidacijska stanja mogu imati pozitivnu, negativnu ili nultu vrijednost, stoga je algebarski zbir oksidacijskih stanja elemenata u molekuli, uzimajući u obzir broj njihovih atoma, jednak 0, au jonu - naboj jona .
1. Oksidacijska stanja metala u jedinjenjima su uvijek pozitivna.
2. Najviše oksidaciono stanje odgovara broju grupe periodnog sistema u kojoj se element nalazi (izuzeci su: Au +3(I grupa), Cu +2(II), iz grupe VIII oksidaciono stanje +8 može se naći samo u osmijumu Os i rutenijum Ru.
3. Stanja oksidacije nemetala zavise od toga s kojim atomom su povezani:
- ako je s atomom metala, tada je oksidacijsko stanje negativno;
- ako s atomom nemetala, tada oksidacijsko stanje može biti pozitivno ili negativno. Zavisi od elektronegativnosti atoma elemenata.
4. Najveće negativno oksidaciono stanje nemetala može se odrediti tako što se od 8 oduzme broj grupe u kojoj se element nalazi, tj. najviše pozitivno oksidaciono stanje je jednako broju elektrona u vanjskom sloju, što odgovara broju grupe.
5. Oksidacijsko stanje jednostavnih supstanci je 0, bez obzira da li je metal ili nemetal.
Elementi sa konstantnim oksidacionim stanjima.
|
Element |
Karakteristično oksidaciono stanje |
Izuzeci |
|
Metalni hidridi: LIH -1 |
||
|
Oksidacijsko stanje naziva se uslovni naboj čestice pod pretpostavkom da je veza potpuno prekinuta (ima jonski karakter). H- Cl = H + + Cl - , Veza u hlorovodoničkoj kiselini je polarna kovalentna. Elektronski par je više pomaknut prema atomu Cl - , jer to je više elektronegativni element. Kako odrediti oksidacijsko stanje?Elektronegativnost je sposobnost atoma da privlače elektrone iz drugih elemenata. Oksidacijski broj je naveden iznad elementa: Br 2 0 , Na 0 , O +2 F 2 -1 ,K + Cl - itd. Može biti negativan i pozitivan. Oksidacijsko stanje jednostavne tvari (nevezano, slobodno stanje) je nula. Oksidacijsko stanje kisika za većinu spojeva je -2 (izuzetak su peroksidi H 2 O 2, gdje je jednako -1 i jedinjenja sa fluorom - O +2 F 2 -1 , O 2 +1 F 2 -1 ). - Oksidacijsko stanje jednostavnog monoatomskog jona jednak je njegovom naboju: Na + , Ca +2 . Vodik u svojim jedinjenjima ima oksidacijsko stanje +1 (izuzeci su hidridi - Na + H - i tip veze C +4 H 4 -1 ). U vezama metal-nemetal, negativno oksidaciono stanje je onaj atom koji ima veću elektronegativnost (podaci o elektronegativnosti dati su u Paulingovoj skali): H + F - , Cu + Br - , Ca +2 (NO 3 ) - itd. Pravila za određivanje stepena oksidacije u hemijskim jedinjenjima.Uzmimo vezu KMnO 4 , potrebno je odrediti oksidacijsko stanje atoma mangana. Obrazloženje:
K+Mn X O 4 -2 Neka X- nama nepoznato oksidaciono stanje mangana. Broj atoma kalija je 1, mangana - 1, kiseonika - 4. Dokazano je da je molekul kao cjelina električno neutralan, pa njegov ukupni naboj mora biti nula. 1*(+1) + 1*(X) + 4(-2) = 0, X = +7, To znači da je oksidaciono stanje mangana u kalijum permanganatu = +7. Uzmimo još jedan primjer oksida Fe2O3. Potrebno je odrediti oksidacijsko stanje atoma željeza. Obrazloženje:
2*(X) + 3*(-2) = 0, Zaključak: oksidacijsko stanje željeza u ovom oksidu je +3. Primjeri. Odredite oksidaciona stanja svih atoma u molekuli. 1. K2Cr2O7. Oksidacijsko stanje K +1, kiseonik O -2. Zadati indeksi: O=(-2)×7=(-14), K=(+1)×2=(+2). Jer algebarski zbir oksidacijskih stanja elemenata u molekuli, uzimajući u obzir broj njihovih atoma, jednak je 0, tada je broj pozitivnih oksidacijskih stanja jednak broju negativnih. Stanja oksidacije K+O=(-14)+(+2)=(-12). Iz ovoga proizilazi da atom hroma ima 12 pozitivnih moći, ali u molekulu postoje 2 atoma, što znači da ima (+12) po atomu: 2 = (+6). odgovor: K 2 + Cr 2 +6 O 7 -2. 2.(AsO 4) 3- . U tom slučaju zbir oksidacijskih stanja više neće biti jednak nuli, već naboju jona, tj. - 3. Napravimo jednačinu: x+4×(- 2)= - 3 . odgovor: (Kao +5 O 4 -2) 3- . |
Video kurs “Osvoji A” obuhvata sve teme potrebne za uspješno polaganje Jedinstvenog državnog ispita iz matematike sa 60-65 bodova. U potpunosti svi zadaci 1-13 profilnog Jedinstvenog državnog ispita iz matematike. Pogodan i za polaganje osnovnog jedinstvenog državnog ispita iz matematike. Ako želite da položite Jedinstveni državni ispit sa 90-100 bodova, trebate riješiti prvi dio za 30 minuta i bez greške!
Pripremni kurs za Jedinstveni državni ispit za 10-11 razred, kao i za nastavnike. Sve što vam je potrebno za rješavanje 1. dijela Jedinstvenog državnog ispita iz matematike (prvih 12 zadataka) i 13. zadatka (trigonometrija). A to je više od 70 bodova na Jedinstvenom državnom ispitu, a bez njih ne mogu ni student sa 100 bodova ni student humanističkih nauka.
Sva potrebna teorija. Brza rješenja, zamke i tajne Jedinstvenog državnog ispita. Analizirani su svi tekući zadaci 1. dijela iz FIPI banke zadataka. Kurs je u potpunosti usklađen sa zahtjevima Jedinstvenog državnog ispita 2018.
Kurs sadrži 5 velikih tema, svaka po 2,5 sata. Svaka tema je data od nule, jednostavno i jasno.
Stotine zadataka Jedinstvenog državnog ispita. Riječni problemi i teorija vjerovatnoće. Jednostavni i lako pamtljivi algoritmi za rješavanje problema. Geometrija. Teorija, referentni materijal, analiza svih vrsta zadataka Jedinstvenog državnog ispita. Stereometrija. Šaljiva rješenja, korisne varalice, razvoj prostorne mašte. Trigonometrija od nule do problema 13. Razumijevanje umjesto nabijanja. Jasna objašnjenja složenih koncepata. Algebra. Korijeni, potencije i logaritmi, funkcija i derivacija. Osnova za rješavanje složenih zadataka 2. dijela Jedinstvenog državnog ispita.
Zadatak određivanja oksidacijskog stanja može biti ili jednostavna formalnost ili složena zagonetka. Prije svega, to će ovisiti o formuli hemijskog jedinjenja, kao i o dostupnosti osnovnih znanja iz hemije i matematike.
Poznavajući osnovna pravila i algoritam sekvencijalnih logičkih radnji o kojima će se raspravljati u ovom članku prilikom rješavanja problema ove vrste, svi se lako mogu nositi s ovim zadatkom. A nakon što vježbate i naučite da odredite oksidacijska stanja različitih kemijskih spojeva, možete bezbedno preuzeti zadatak balansiranja složenih redoks reakcija sastavljanjem elektronske ravnoteže.
Koncept oksidacionog stanja
Da biste naučili kako odrediti stupanj oksidacije, prvo morate razumjeti što ovaj koncept znači?
- Oksidacijski broj se koristi kada se piše u redoks reakcijama kada se elektroni prenose s atoma na atom.
- Oksidacijsko stanje bilježi broj prenesenih elektrona, što ukazuje na uvjetni naboj atoma.
- Oksidacijsko stanje i valencija su često identični.
Ova oznaka je napisana na vrhu hemijskog elementa, u njegovom desnom uglu, i predstavlja ceo broj sa znakom “+” ili “-”. Nulta vrijednost oksidacijskog stanja ne nosi znak.
Pravila za određivanje stepena oksidacije
Razmotrimo glavne kanone za određivanje oksidacijskog stanja:
- Jednostavne elementarne tvari, odnosno one koje se sastoje od jedne vrste atoma, uvijek će imati nulto oksidacijsko stanje. Na primjer, Na0, H02, P04
- Postoji veliki broj atoma koji uvijek imaju jedno, konstantno, oksidacijsko stanje. Bolje je zapamtiti vrijednosti date u tabeli.
- Kao što vidite, jedini izuzetak je kod vodonika u kombinaciji s metalima, gdje on poprima oksidacijsko stanje "-1" koje nije karakteristično za njega.
- Kiseonik takođe poprima oksidaciono stanje "+2" u hemijskom jedinjenju sa fluorom i "-1" u peroksidnim, superoksidnim ili ozonidnim jedinjenjima gde su atomi kiseonika međusobno povezani.


- Metalni joni imaju nekoliko oksidacionih stanja (i to samo pozitivna), pa je determinisana susjednim elementima u spoju. Na primjer, u FeCl3, klor ima oksidacijsko stanje "-1", ima 3 atoma, pa pomnožimo -1 sa 3, dobijemo "-3". Da bi zbir oksidacionih stanja jedinjenja bio „0“, gvožđe mora imati oksidaciono stanje „+3“. U formuli FeCl2, gvožđe će prema tome promeniti svoj stepen na „+2“.
- Matematičkim zbrajanjem oksidacionih stanja svih atoma u formuli (uzimajući u obzir predznake), uvijek treba dobiti nultu vrijednost. Na primjer, u hlorovodoničkoj kiselini H+1Cl-1 (+1 i -1 = 0), iu sumpornoj kiselini H2+1S+4O3-2 (+1 * 2 = +2 za vodonik, +4 za sumpor i -2 * 3 = – 6 za kiseonik +6 i -6 sabiraju do 0).
- Oksidacijsko stanje jednoatomnog jona bit će jednako njegovom naboju. Na primjer: Na+, Ca+2.
- Najveće oksidaciono stanje, po pravilu, korelira sa brojem grupe u periodičnom sistemu D.I.


Algoritam za određivanje stepena oksidacije
Redoslijed pronalaženja oksidacijskog stanja nije kompliciran, ali zahtijeva pažnju i određene radnje.
Zadatak: urediti oksidaciona stanja u jedinjenju KMnO4
- Prvi element, kalij, ima konstantno stanje oksidacije „+1“.
Da biste provjerili, možete pogledati periodni sistem, gdje je kalij u grupi 1 elemenata. - Od preostala dva elementa, kisik ima tendenciju da ima oksidacijsko stanje od -2.
- Dobijamo sljedeću formulu: K+1MnxO4-2. Ostaje odrediti oksidacijsko stanje mangana.
Dakle, x je nama nepoznato oksidaciono stanje mangana. Sada je važno obratiti pažnju na broj atoma u spoju.
Broj atoma kalija je 1, mangana je 1, kiseonika je 4.
Uzimajući u obzir električnu neutralnost molekule, kada je ukupni (ukupni) naboj nula,
1*(+1) + 1*(x) + 4(-2) = 0,
+1+1h+(-8) = 0,
-7+1x = 0,
(pri transferu mijenjamo znak)
1x = +7, x = +7
Dakle, oksidaciono stanje mangana u jedinjenju je „+7“.
Zadatak: urediti oksidaciona stanja u jedinjenju Fe2O3.
- Kiseonik, kao što je poznato, ima oksidaciono stanje "-2" i deluje kao oksidaciono sredstvo. Uzimajući u obzir broj atoma (3), ukupna vrijednost za kiseonik je “-6” (-2*3= -6), tj. pomnožite oksidacijski broj sa brojem atoma.
- Da bi se formula izbalansirala i dovela na nulu, 2 atoma gvožđa će imati oksidaciono stanje „+3“ (2*+3=+6).
- Ukupno je nula (-6 i +6 = 0).
Zadatak: urediti oksidaciona stanja u jedinjenju Al(NO3)3.
- Postoji samo jedan atom aluminijuma i ima konstantno oksidaciono stanje „+3“.
- U molekulu ima 9 atoma kiseonika (3*3), oksidaciono stanje kiseonika, kao što je poznato, je “-2”, što znači da množenjem ovih vrednosti dobijamo “-18”.
- Ostaje da se izjednače negativne i pozitivne vrijednosti, čime se određuje stepen oksidacije dušika. -18 i +3, +15 nedostaje A s obzirom da postoje 3 atoma dušika, lako je odrediti njegovo oksidacijsko stanje: podijeliti 15 sa 3 i dobiti 5.
- Oksidacijsko stanje dušika je "+5", a formula će izgledati ovako: Al+3(N+5O-23)3
- Ako je teško odrediti željenu vrijednost na ovaj način, možete sastaviti i riješiti jednadžbe:
1*(+3) + 3x + 9*(-2) = 0.
+3+3x-18=0
3x=15
x=5


Dakle, oksidacijsko stanje je prilično važan koncept u hemiji, simbolizirajući stanje atoma u molekuli.
Bez poznavanja određenih odredbi ili osnova koje vam omogućavaju da ispravno odredite stupanj oksidacije, nemoguće je nositi se s ovim zadatkom. Stoga postoji samo jedan zaključak: temeljito se upoznajte i proučite pravila za pronalaženje oksidacijskog stanja, jasno i koncizno predstavljena u članku, i hrabro krenite dalje teškim putem kemijskih zamršenosti.
Kako odrediti oksidacijsko stanje? Periodni sistem vam omogućava da zabilježite ovu kvantitativnu vrijednost za bilo koji hemijski element.
Definicija
Prvo, pokušajmo da shvatimo šta ovaj pojam predstavlja. Oksidacijsko stanje prema periodnom sistemu predstavlja broj elektrona koje element prihvati ili odustane u procesu kemijske interakcije. Može poprimiti negativnu i pozitivnu vrijednost.
Povezivanje sa tabelom
Kako se određuje oksidacijsko stanje? Periodični sistem se sastoji od osam grupa raspoređenih okomito. Svaka od njih ima dvije podgrupe: glavnu i sekundarnu. Da biste postavili metriku za elemente, morate koristiti određena pravila.

Uputstva
Kako izračunati oksidaciona stanja elemenata? Tablica vam omogućava da se u potpunosti nosite s ovim problemom. Alkalni metali, koji se nalaze u prvoj grupi (glavna podgrupa), ispoljavaju oksidaciono stanje u jedinjenjima, ono odgovara +, jednako njihovoj najvišoj valenciji. Metali druge grupe (podgrupa A) imaju oksidaciono stanje +2.
Tabela vam omogućava da odredite ovu vrijednost ne samo za elemente koji pokazuju metalna svojstva, već i za nemetale. Njihova maksimalna vrijednost će odgovarati najvišoj valenciji. Na primjer, za sumpor će biti +6, za dušik +5. Kako se izračunava njihov minimalni (najniži) broj? Tabela takođe odgovara na ovo pitanje. Trebate oduzeti broj grupe od osam. Na primjer, za kisik će biti -2, za dušik -3.
Za jednostavne supstance koje nisu ušle u hemijsku interakciju sa drugim supstancama, utvrđeni indikator se smatra jednakim nuli.
Pokušajmo identificirati glavne radnje vezane za raspored u binarnim spojevima. Kako podesiti oksidacijsko stanje u njima? Periodični sistem pomaže u rješavanju problema.
Na primjer, uzmimo kalcijev oksid CaO. Za kalcij, koji se nalazi u glavnoj podgrupi druge grupe, vrijednost će biti konstantna, jednaka +2. Za kisik, koji ima nemetalna svojstva, ovaj indikator će biti negativna vrijednost i odgovara -2. Da bismo provjerili tačnost definicije, sumiramo dobijene brojke. Kao rezultat, dobijamo nulu, dakle, proračuni su tačni.
Odredimo slične indikatore u drugom binarnom spoju CuO. Kako se bakar nalazi u sekundarnoj podgrupi (prva grupa), indikator koji se proučava može imati različite vrijednosti. Stoga, da biste ga odredili, prvo morate identificirati indikator za kisik.
Nemetal koji se nalazi na kraju binarne formule ima negativan oksidacijski broj. Pošto se ovaj element nalazi u šestoj grupi, kada oduzmemo šest od osam, dobijamo da oksidaciono stanje kiseonika odgovara -2. Budući da u spoju nema indeksa, indeks oksidacijskog stanja bakra će biti pozitivan, jednak +2.
Kako se još koristi hemijska tablica? Oksidacijska stanja elemenata u formulama koje se sastoje od tri elementa također se izračunavaju pomoću specifičnog algoritma. Prvo, ovi indikatori se postavljaju na prvi i posljednji element. Za prvo, ovaj indikator će imati pozitivnu vrijednost, što odgovara valentnosti. Za najudaljeniji element, koji je nemetal, ovaj indikator ima negativnu vrijednost, određuje se kao razlika (broj grupe se oduzima od osam). Prilikom izračunavanja oksidacijskog stanja centralnog elementa koristi se matematička jednadžba. Prilikom izračunavanja uzimaju se u obzir dostupni indeksi za svaki element. Zbir svih oksidacijskih stanja mora biti nula.

Primjer određivanja u sumpornoj kiselini
Formula ovog jedinjenja je H 2 SO 4. Vodik ima oksidaciono stanje +1, a kiseonik oksidaciono stanje -2. Da bismo odredili oksidaciono stanje sumpora, kreiramo matematičku jednačinu: + 1 * 2 + X + 4 * (-2) = 0. Nalazimo da oksidaciono stanje sumpora odgovara +6.

Zaključak
Kada koristite pravila, možete dodijeliti koeficijente u redoks reakcijama. O ovom pitanju se govori u predmetu hemije za deveti razred školskog programa. Osim toga, informacije o oksidacijskim stanjima omogućavaju vam da dovršite OGE i USE zadatke.
Mnogi školski udžbenici i priručnici podučavaju kako se kreiraju formule zasnovane na valencijama, čak i za jedinjenja sa jonskim vezama. Da bi se pojednostavila procedura sastavljanja formula, ovo je, po našem mišljenju, prihvatljivo. Ali morate shvatiti da to nije sasvim točno zbog gore navedenih razloga.
Univerzalni koncept je koncept oksidacionog stanja. Koristeći oksidacijska stanja atoma, kao i vrijednosti valencije, možete sastaviti kemijske formule i zapisati jedinice formule.
Oksidacijsko stanje- ovo je uslovni naboj atoma u čestici (molekula, jon, radikal), izračunat u aproksimaciji da su sve veze u čestici jonske.
Prije određivanja oksidacijskih stanja potrebno je uporediti elektronegativnost vezanih atoma. Atom s višom vrijednošću elektronegativnosti ima negativno oksidacijsko stanje, a atom sa nižom elektronegativnošću ima pozitivno oksidacijsko stanje.
Kako bi se objektivno uporedile vrijednosti elektronegativnosti atoma pri izračunavanju oksidacijskih stanja, IUPAC je 2013. preporučio korištenje Allenove skale.
* Tako, na primjer, prema Alenovoj skali, elektronegativnost dušika je 3,066, a hlora 2,869.
Ilustrirajmo gornju definiciju primjerima. Hajde da sastavimo strukturnu formulu molekula vode.

Kovalentne polarne O-H veze su označene plavom bojom.
Zamislimo da obje veze nisu kovalentne, već jonske. Da su ionski, tada bi jedan elektron prešao sa svakog atoma vodika na elektronegativniji atom kisika. Označimo ove prijelaze plavim strelicama.
*U ovomeNa primjer, strelica služi za vizualnu ilustraciju kompletnog prijenosa elektrona, a ne za ilustraciju induktivnog efekta.

Lako je primijetiti da broj strelica pokazuje broj prenesenih elektrona, a njihov smjer pokazuje smjer prijenosa elektrona.
Dvije su strelice usmjerene na atom kisika, što znači da se dva elektrona prenose na atom kisika: 0 + (-2) = -2. Na atomu kiseonika formira se naboj od -2. Ovo je stanje oksidacije kisika u molekuli vode.
Svaki atom vodonika izgubi jedan elektron: 0 - (-1) = +1. To znači da atomi vodika imaju oksidacijsko stanje od +1.

Zbir oksidacijskih stanja uvijek je jednak ukupnom naboju čestice.
Na primjer, zbir oksidacijskih stanja u molekulu vode jednak je: +1(2) + (-2) = 0. Molekul je električki neutralna čestica.
Ako izračunamo oksidaciona stanja u jonu, onda je zbir oksidacionih stanja u skladu s tim jednak njegovom naboju.
Vrijednost oksidacijskog stanja obično je naznačena u gornjem desnom kutu simbola elementa. Štaviše, znak je ispisan ispred broja. Ako je znak iza broja, onda je to naboj jona.
Na primjer, S -2 je atom sumpora u oksidacionom stanju -2, S 2- je anjon sumpora sa nabojem od -2.
S +6 O -2 4 2- - vrijednosti oksidacijskih stanja atoma u sulfatnom anionu (naboj jona je označen zelenom bojom).
Sada razmotrite slučaj kada jedinjenje ima mješovite veze: Na 2 SO 4. Veza između sulfatnog anjona i kationa natrijuma je jonska, veze između atoma sumpora i atoma kiseonika u sulfatnom jonu su polarne kovalentne. Zapišimo grafičku formulu natrijum sulfata i strelicama označimo smjer prijelaza elektrona.
*Strukturna formula prikazuje red kovalentnih veza u čestici (molekula, jon, radikal). Strukturne formule se koriste samo za čestice sa kovalentnim vezama. Za čestice s ionskim vezama, koncept strukturne formule nema značenje. Ako čestica sadrži ionske veze, tada se koristi grafička formula.

Vidimo da šest elektrona napušta centralni atom sumpora, što znači da je oksidaciono stanje sumpora 0 - (-6) = +6.
Svaki terminalni atom kiseonika prima dva elektrona, što znači da su njihova oksidaciona stanja 0 + (-2) = -2
Premosni atomi kiseonika svaki prihvataju dva elektrona i imaju oksidaciono stanje od -2.
Također je moguće odrediti stupanj oksidacije koristeći strukturno-grafičku formulu, gdje su kovalentne veze označene crticama, a naboj iona.
U ovoj formuli, premosni atomi kiseonika već imaju pojedinačne negativne naboje i dodatni elektron im dolazi od atoma sumpora -1 + (-1) = -2, što znači da su njihova oksidaciona stanja jednaka -2.
Stepen oksidacije jona natrijuma jednak je njihovom naboju, tj. +1.

Odredimo oksidaciona stanja elemenata u kalijevom superoksidu (superoksidu). Da bismo to učinili, napravimo grafičku formulu za kalijev superoksid i strelicom pokažemo preraspodjelu elektrona. O-O veza je kovalentna nepolarna veza, tako da u njoj nema preraspodjele elektrona.
* Superoksidni anion je radikalni jon. Formalni naboj jednog atoma kiseonika je -1, a drugog, sa nesparenim elektronom, je 0.

Vidimo da je oksidaciono stanje kalijuma +1. Oksidacijsko stanje atoma kisika napisano nasuprot kalija u formuli je -1. Oksidacijsko stanje drugog atoma kisika je 0.
Na isti način možete odrediti stupanj oksidacije koristeći strukturno-grafičku formulu.

Krugovi označavaju formalne naboje jona kalija i jednog od atoma kisika. U ovom slučaju, vrijednosti formalnih naboja poklapaju se s vrijednostima oksidacijskih stanja.
Budući da oba atoma kisika u superoksidnom anionu imaju različita oksidacijska stanja, možemo izračunati aritmetička sredina oksidacionog stanja kiseonik.
Bit će jednako / 2 = - 1/2 = -0,5.
Vrijednosti aritmetičkih srednjih oksidacijskih stanja obično su naznačene u bruto formulama ili jedinicama formule kako bi se pokazalo da je zbir oksidacijskih stanja jednak ukupnom naboju sistema.
Za slučaj sa superoksidom: +1 + 2(-0,5) = 0

Lako je odrediti oksidaciona stanja pomoću formula elektronskih tačaka, u kojima su usamljeni elektronski parovi i elektroni kovalentnih veza označeni tačkama.

Kiseonik je element grupe VIA, stoga njegov atom ima 6 valentnih elektrona. Zamislimo da su veze u molekuli vode jonske, u ovom slučaju bi atom kiseonika primio oktet elektrona.
Oksidacijsko stanje kiseonika je odgovarajuće: 6 - 8 = -2.
A atomi vodonika: 1 - 0 = +1
Sposobnost određivanja stanja oksidacije pomoću grafičkih formula je od neprocjenjive važnosti za razumijevanje suštine ovog koncepta. Ako je riječ o neorganskim tvarima, onda je potrebno znati odrediti oksidacijska stanja pomoću molekularnih formula i jedinica formule.
Da biste to učinili, prije svega morate razumjeti da oksidacijska stanja mogu biti konstantna i promjenjiva. Elementi koji pokazuju konstantna oksidaciona stanja moraju se zapamtiti.

Svaki kemijski element karakteriziraju najviša i najniža oksidacijska stanja.
Najniže oksidaciono stanje- ovo je naboj koji atom stječe kao rezultat primanja maksimalnog broja elektrona na vanjskom sloju elektrona.
S obzirom na ovo, najniže oksidaciono stanje ima negativnu vrijednost, sa izuzetkom metala, čiji atomi nikada ne prihvataju elektrone zbog niskih vrednosti elektronegativnosti. Metali imaju najniže oksidaciono stanje 0.
Većina nemetala glavnih podgrupa pokušava ispuniti svoj vanjski elektronski sloj sa do osam elektrona, nakon čega atom poprima stabilnu konfiguraciju ( pravilo okteta). Stoga, da bi se odredilo najniže oksidacijsko stanje, potrebno je razumjeti koliko valentnih elektrona nedostaje atomu da dođe do okteta.
Na primjer, dušik je element grupe VA, što znači da atom dušika ima pet valentnih elektrona. Atomu dušika nedostaju tri elektrona od okteta. To znači da je najniže stanje oksidacije dušika: 0 + (-3) = -3