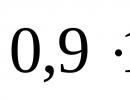Oksidi i hidroksidi. Karbonati. Fosfati. Dobivanje sode bikarbone
Natrijum pripada alkalnim metalima i nalazi se u glavnoj podgrupi prve grupe PSE po imenu. DI. Mendeljejev. Na vanjskom energetskom nivou njegovog atoma, na relativno velikoj udaljenosti od jezgra, nalazi se jedan elektron kojeg atomi alkalnog metala prilično lako odustaju, pretvarajući se u jednonabijene katione; Ovo objašnjava veoma visoku hemijsku aktivnost alkalnih metala.
Uobičajena metoda za proizvodnju alkalnih spojeva je elektroliza rastopljenih soli (obično klorida).
Natrijum, kao alkalni metal, karakteriše niska tvrdoća, niska gustina i niske tačke topljenja.
Natrijum, u interakciji sa kiseonikom, formira pretežno natrijum peroksid
2 Na + O2 Na2O2
Redukovanjem peroksida i superoksida viškom alkalnog metala može se dobiti sljedeći oksid:
Na2O2 + 2 Na 2 Na2O
Natrijum oksidi reaguju sa vodom i formiraju hidroksid: Na2O + H2O → 2 NaOH.
Peroksidi se potpuno hidroliziraju vodom i formiraju alkalije: Na2O2 + 2 HOH → 2 NaOH + H2O2
Kao i svi alkalni metali, natrijum je jako redukciono sredstvo i snažno reaguje sa mnogim nemetalima (s izuzetkom azota, joda, ugljenika, plemenitih gasova):
Izuzetno slabo reaguje sa dušikom u usijanom pražnjenju, formirajući vrlo nestabilnu supstancu - natrijum nitrid
Reaguje sa razrijeđenim kiselinama poput običnog metala:
S koncentriranim oksidirajućim kiselinama oslobađaju se produkti redukcije:
Natrijev hidroksid NaOH (kaustična alkalija) je jaka hemijska baza. U industriji se natrijum hidroksid proizvodi hemijskim i elektrohemijskim metodama.
Hemijske metode pripreme:
Kreč, koji uključuje interakciju rastvora sode sa krečnim mlekom na temperaturi od oko 80°C. Ovaj proces se naziva kaustizacija; prolazi kroz reakciju:
Na 2 CO 3 + Ca (OH) 2 → 2NaOH + CaCO 3
Feritni, koji uključuje dvije faze:
Na 2 CO 3 + Fe 2 O 3 → 2NaFeO 2 + CO 2
2NaFeO 2 + xH 2 O = 2NaOH + Fe 2 O 3 * xH 2 O
Elektrohemijski, natrijum hidroksid se proizvodi elektrolizom rastvora halita (minerala koji se uglavnom sastoji od natrijum hlorida NaCl) uz istovremenu proizvodnju vodonika i hlora. Ovaj proces se može predstaviti zbirnom formulom:
2NaCl + 2H 2 O ±2e- → H 2 + Cl 2 + 2NaOH
Natrijum hidroksid reaguje:
1) neutralizacija:
NaOH + HCl → NaCl + H2O
2) izmjena sa solima u rastvoru:
2NaOH + CuSO 4 → Cu (OH) 2 ↓ + Na 2 SO 4
3) reaguje sa nemetalima
3S + 6NaOH → 2Na2S + Na2SO3 + 3H2O
4) reaguje sa metalima
2Al + 2NaOH + 6H 2 O → 3H 2 + 2Na
Natrijum hidroksid se široko koristi u raznim industrijama, na primjer, u pulpi, za saponifikaciju masti u proizvodnji sapuna; kao katalizator hemijskih reakcija u proizvodnji dizel goriva itd.
Natrijum karbonat Proizvodi se ili u obliku Na 2 CO 3 (soda pepela), ili u obliku kristalnog hidrata Na 2 CO 3 *10H 2 O (kristalna soda), ili u obliku bikarbonata NaHCO 3 (soda bikarbona).
Soda se najčešće proizvodi metodom amonijevog klorida, baziranom na reakciji:
NaCl + NH 4 HCO 3 ↔NaHCO 3 + NH4Cl
Mnoge industrije troše natrijum karbonate: hemijska, sapunska, celulozna i papirna, tekstilna, prehrambena itd.
Soda bikarbona ili soda za piće je spoj koji je nadaleko poznat u medicini, kulinarstvu i potrošnji u domaćinstvu. Ovo je kisela sol, čiju molekulu formiraju pozitivno nabijeni ioni natrija i vodika, te anjon kiselog ostatka ugljične kiseline. Hemijski naziv sode je natrijum bikarbonat ili natrijum bikarbonat. Formula jedinjenja prema Hill sistemu: CHNaO 3 (bruto formula).
Razlika između kisele i srednje soli
Ugljena kiselina formira dvije grupe soli - karbonate (srednje) i bikarbonate (kiseline). Trivijalni naziv za karbonate - soda - pojavio se u davna vremena. Potrebno je razlikovati srednje i kisele soli po nazivima, formulama i svojstvima.
Na 2 CO 3 - natrijum karbonat, dinatrijum karbonat, soda za pranje. Služi kao sirovina za proizvodnju stakla, papira, sapuna, a koristi se i kao deterdžent.
NaHCO 3 - natrijum bikarbonat. Sastav sugerira da je tvar mononatrijeva sol ugljične kiseline. Ovaj spoj se odlikuje prisustvom dva različita pozitivna jona - Na + i H +. Izvana, kristalne bijele tvari su slične, teško ih je razlikovati jedna od druge.
Supstanca NaHCO 3 se smatra sodom bikarbonom ne zato što se koristi interno za gašenje žeđi. Iako se ova tvar može koristiti za pripremu gaziranog pića. Rastvor ovog bikarbonata uzima se oralno u slučaju povećane kiselosti želudačnog soka. U tom slučaju neutralizira se višak H+ protona, koji iritiraju zidove želuca, uzrokujući bol i peckanje.
Fizička svojstva sode bikarbone
Bikarbonat je bijeli monoklinski kristal. Ovo jedinjenje sadrži atome natrijuma (Na), vodonika (H), ugljenika (C) i kiseonika. Gustina supstance je 2,16 g/cm3. Tačka topljenja - 50-60 °C. Natrijum bikarbonat je mlečno-beli prah, čvrsto, fino kristalno jedinjenje, rastvorljivo u vodi. Soda bikarbona ne gori, a kada se zagrije iznad 70°C, razlaže se na natrijum karbonat, ugljični dioksid i vodu. U proizvodnim uvjetima češće se koristi granulirani bikarbonat.

Sigurnost sode bikarbone za ljude
Jedinjenje je bez mirisa, a okus mu je gorak i slan. Međutim, nije preporučljivo mirisati ili kušati supstancu. Udisanje natrijum bikarbonata može izazvati kihanje i kašalj. Jedna upotreba se zasniva na sposobnosti sode bikarbone da neutrališe mirise. Prašak se može koristiti za tretiranje sportske obuće kako biste se riješili neugodnih mirisa.
Soda bikarbona (natrijum bikarbonat) je bezopasna tvar u dodiru s kožom, ali u čvrstom obliku može izazvati iritaciju sluzokože očiju i jednjaka. U niskim koncentracijama otopina je netoksična i može se uzimati oralno.
Natrijum bikarbonat: formula jedinjenja
Bruto formula CHNaO 3 rijetko se nalazi u jednačinama kemijskih reakcija. Činjenica je da ne odražava vezu između čestica koje formiraju natrijum bikarbonat. Formula koja se obično koristi za karakterizaciju fizičkih i hemijskih svojstava supstance je NaHCO 3 . Relativni raspored atoma reflektuje se modelom kugle i štapa molekula:

Ako iz periodnog sistema saznate atomske mase natrijuma, kiseonika, ugljenika i vodika. tada možete izračunati molarnu masu supstance natrijum bikarbonata (formula NaHCO 3):
Ar(Na) - 23;
Ar(O) - 16;
Ar(C) - 12;
Ar(H) - 1;
M (CHNaO 3) = 84 g/mol.
Struktura materije
Natrijum bikarbonat je jonsko jedinjenje. Kristalna rešetka uključuje natrijev kation Na +, koji zamjenjuje jedan atom vodika u ugljičnoj kiselini. Sastav i naboj anjona je HCO 3 -. Nakon rastvaranja dolazi do djelomične disocijacije na jone koji formiraju natrijum bikarbonat. Formula koja odražava strukturne karakteristike izgleda ovako:

Rastvorljivost sode bikarbone u vodi
7,8 g natrijum bikarbonata se rastvara u 100 g vode. Supstanca se podvrgava hidrolizi:
NaHCO 3 = Na + + HCO 3 - ;
H 2 O ↔ H + + OH - ;
Prilikom sažimanja jednadžbi ispada da se hidroksidni ioni akumuliraju u otopini (slabo alkalna reakcija). Tečnost postaje fenolftalein ružičasta. Boja univerzalnih indikatora u obliku papirnatih traka u otopini sode mijenja se od žuto-narančaste do sive ili plave.
Reakcija zamjene s drugim solima
Vodeni rastvor natrijum bikarbonata ulazi u reakcije jonske izmene sa drugim solima, pod uslovom da je jedna od novonastalih supstanci nerastvorljiva; ili se formira gas koji se uklanja iz reakcione sfere. Prilikom interakcije s kalcijum hloridom, kao što je prikazano na donjem dijagramu, dobijaju se i bijeli talog kalcijum karbonata i ugljični dioksid. Joni natrijuma i hlora ostaju u rastvoru. Molekularna jednadžba reakcije:

Interakcija sode bikarbone sa kiselinama
Natrijum bikarbonat reaguje sa kiselinama. Reakcija ionske izmjene je praćena stvaranjem soli i slabe ugljične kiseline. U trenutku prijema se razlaže na vodu i ugljični dioksid (isparava).
Zidovi ljudskog želuca proizvode hlorovodoničnu kiselinu koja postoji u obliku jona
H + i Cl - . Ako natrijum bikarbonat uzimate oralno, u rastvoru želudačnog soka se javljaju reakcije uz učešće jona:
NaHCO 3 = Na + + HCO 3 - ;
HCl = H + + Cl - ;
H 2 O ↔ H+ + OH -;
HCO 3 - + H + = H 2 O + CO 2.
Ljekari ne preporučuju stalnu upotrebu natrijum bikarbonata u slučaju povećane kiselosti želuca. Upute za lijekove navode različite nuspojave svakodnevne i dugotrajne upotrebe sode bikarbone:
- povišen krvni pritisak;
- podrigivanje, mučnina i povraćanje;
- anksioznost, loš san;
- smanjen apetit;
- bol u stomaku.

Dobivanje sode bikarbone
U laboratoriji se natrijum bikarbonat može dobiti iz sode pepela. Ista metoda se ranije koristila u hemijskoj proizvodnji. Moderna industrijska metoda temelji se na interakciji amonijaka sa ugljičnim dioksidom i slaboj rastvorljivosti sode bikarbone u hladnoj vodi. Amonijak i ugljični dioksid (ugljični dioksid) prolaze kroz otopinu natrijum hlorida. Nastaju amonijum hlorid i rastvor natrijum bikarbonata. Kada se ohladi, rastvorljivost sode bikarbone se smanjuje, tada se tvar lako odvaja filtriranjem.
Gdje se koristi natrijum bikarbonat? Upotreba sode bikarbone u medicini
Mnogi ljudi znaju da atomi metala natrijuma snažno stupaju u interakciju s vodom, čak i s njenom parom u zraku. Reakcija počinje aktivno i praćena je oslobađanjem velike količine topline (sagorijevanje). Za razliku od atoma, joni natrija su stabilne čestice koje ne oštećuju živi organizam. Naprotiv, oni aktivno učestvuju u regulisanju njegovih funkcija.
Kako se koristi supstanca, natrijum bikarbonat, koja je netoksična za ljude i korisna u mnogim aspektima? Aplikacija se temelji na fizičkim i kemijskim svojstvima sode bikarbone. Najvažnije oblasti su potrošnja domaćinstava, prehrambena industrija, zdravstvo, tradicionalna medicina i pića.
Među glavnim svojstvima natrijum bikarbonata je neutralizacija povećane kiselosti želudačnog soka, kratkotrajno otklanjanje bolova usled hiperacidnosti želudačnog soka, čira na želucu i dvanaestopalačnom crevu. Antiseptički učinak rastvora sode bikarbone koristi se u liječenju upale grla, kašlja, intoksikacije i morske bolesti. Njime operite usnu i nosnu šupljinu i sluzokožu očiju.

Široko se koriste različiti oblici doziranja natrijum bikarbonata, kao što su prašci, koji se rastvaraju i koriste za infuziju. Otopine se propisuju pacijentima za oralno uzimanje, a opekotine se ispiru kiselinama. Natrijum bikarbonat se takođe koristi za pravljenje tableta i rektalnih supozitorija. Upute za lijekove sadrže detaljan opis farmakološkog djelovanja i indikacija. Lista kontraindikacija je vrlo kratka - individualna netolerancija na supstancu.
Upotreba sode bikarbone kod kuće
Natrijum bikarbonat je "hitna pomoć" za žgaravicu i trovanje. Koristeći sodu bikarbonu kod kuće, možete izbjeliti zube, smanjiti upalu tokom akni i prebrisati kožu kako biste uklonili višak masnih sekreta. Natrijum bikarbonat omekšava vodu i pomaže u čišćenju prljavštine sa različitih površina.
Prilikom ručnog pranja vunene trikotaže u vodu možete dodati sodu bikarbonu. Ova supstanca osvježava boju tkanine i uklanja miris znoja. Često se prilikom peglanja svilenih proizvoda pojavljuju žute mrlje od glačala. U ovom slučaju pomoći će vam pasta od sode bikarbone i vode. Tvari se moraju pomiješati što je prije moguće i nanijeti na mrlju. Kada se pasta osuši, treba je očistiti četkom i isprati proizvod u hladnoj vodi.
U reakciji sa sirćetnom kiselinom dobija se natrijum acetat i brzo se oslobađa ugljični dioksid koji pjeni cijelu masu: NaHCO 3 + CH 3 COOH = Na + + CH 3 COO - + H 2 O + CO 2. Ovaj proces se dešava kad god se u proizvodnji gaziranih pića i konditorskih proizvoda soda bikarbona „gasi” sirćetom.

Okus peciva će biti delikatniji ako koristite limunov sok, a ne sintetičko sirće kupljeno u prodavnici. U krajnjem slučaju, možete ga zamijeniti mješavinom od 1/2 žličice. limunske kiseline u prahu i 1 žlica. l. vode. U testo se dodaje soda bikarbona sa kiselinom kao jedan od poslednjih sastojaka kako biste pečene odmah mogli da stavite u rernu. Osim natrijum bikarbonata, amonijum bikarbonat se ponekad koristi kao sredstvo za dizanje.
Komercijalni proizvod u metodama prerade sirovina koje sadrže litijum o kojima se govorilo je litijum karbonat. Izuzetak je metoda kreča. Litijum karbonat se koristi direktno, a osim toga služi i kao izvor za proizvodnju različitih litijevih spojeva od kojih su glavni hidroksid i hlorid.
Priprema litijum hidroksida. Jedina industrijska metoda za proizvodnju litijum hidroksida je kaustifikacija sa vapnom u rastvoru:
Li 2 CO 3 + Ca(OH) 2 → 2LiOH + CaCO 3 (36)
Donji podaci o rastvorljivosti (20 ºS) komponenti reakcije 34 (tabela 5) pokazuju da ravnotežu reakcije treba pomeriti udesno:
Tabela 5
| Compound | Li 2 CO 3 | Ca(OH)2 | LiOH | CaCO3 |
| Rastvorljivost, g/100g H 2 O | 0,13 | 0,165 | 12,8 | 1,3 ∙ 10 -3 |
Istovremeno, iz podataka o rastvorljivosti u sistemu Li 2 CO 3 - Ca(OH) 2 - H 2 O na 75 ºC proizilazi da maksimalna koncentracija LiOH ne može biti veća od 36 g/l, tj. Mogu se dobiti samo razrijeđene otopine LiOH. Početni proizvod tokom kaustizacije je vlažni litijum karbonat. Litijum karbonat i kalcijum hidroksid se mešaju u reaktoru; kreč se uzima u količini od 105% od teorijske. Reakciona masa se zagreva do ključanja. Zatim se pulpa taloži i bistreni rastvor se dekantuje. Sadrži 28,5-35,9 g/l LiOH. Suspenzija (kalcijum karbonat) se podvrgava trostepenom protivstrujnom ispiranju radi dalje ekstrakcije litijuma. Glavni rastvor je uparen do 166,6 g/l LiOH. Tada temperatura pada na 40 ºS. Litijum hidroksid se izoluje u obliku monohidrata LiOH∙H 2 O, čiji se kristali odvajaju od matične tečnosti centrifugiranjem. Da bi se dobilo čisto jedinjenje, primarni proizvod se rekristališe. Prinos litijuma u gotovom proizvodu je 85-90%. Glavni nedostatak metode su visoki zahtjevi za čistoćom polaznih proizvoda. Litijum karbonat mora sadržavati minimalnu količinu nečistoća, posebno hlorida. Kreč ne bi trebao sadržavati aluminij kako bi se izbjeglo stvaranje slabo rastvorljivog litijum aluminata.
Priprema litijum hlorida. Industrijska metoda za proizvodnju litijum hlorida zasniva se na rastvaranju litij karbonata ili hidroksida u hlorovodoničkoj kiselini, a obično se koristi karbonat:
Li 2 CO 3 + HCl → 2LiCl + H 2 O + CO 2 (37)
LiOH + HCl → LiCl + H 2 O (38)
Tehnički litijum karbonat i hidroksid sadrže značajnu količinu nečistoća koje se prvo moraju ukloniti. Litijum karbonat se obično prečišćava pretvaranjem u visoko rastvorljiv hidrogen karbonat, nakon čega sledi dekarbonizacija i oslobađanje Li 2 CO 3 . Nakon prečišćavanja litijum karbonata koji sadrži 0,87 g/l SO 4 2- i 0,5% alkalnih metala, dobija se proizvod koji sadrži tragove sumpora i 0,03-0,07% alkalnih metala. Za pročišćavanje hidroksida koristi se rekristalizacija ili taloženje Li 2 CO 3 karbonizacijom otopine. Šematski dijagram proizvodnje litijum hlorida iz karbonata prikazan je na Sl. 16.
Rice. 16. Šematski dijagram za proizvodnju litijum hlorida
Proces proizvodnje litijum hlorida povezan je sa dve poteškoće - isparavanjem rastvora i dehidracijom soli. Litijum hlorid i njegove otopine su vrlo korozivne, a bezvodna sol je visoko higroskopna. Litijum hlorid zagrevanjem uništava gotovo sve metale osim platine i tantala, pa se za isparavanje rastvora LiCl koristi oprema od specijalnih legura, a za dehidraciju keramička oprema.
Za dobijanje litijum hlorida koristi se mokri karbonat koji se tretira sa 30% HCl. Dobijeni rastvor sadrži ~360 g/l LiCl (gustina 1,18-1,19 g/cm3). Za rastvaranje se daje mali višak kiseline i, nakon miješanja, sulfatni joni se precipitiraju sa barijevim hloridom. Otopina se zatim neutralizira litijum karbonatom i dodaje se LiOH da se dobije 0,01 N rastvor LiOH. Otopina se kuha kako bi se oslobodili Ca, Ba, Mg, Fe i druge nečistoće u obliku hidroksida, karbonata ili baznih karbonata.
Nakon filtriranja dobija se 40% rastvor LiCl čiji se deo direktno koristi, a veći deo se prerađuje u bezvodnu so.Bezvodni litijum hlorid se dobija u tornju za isparavanje i serijski spojenom bubnju za sušenje. Sadržaj nečistoća u litijum hloridu je dat u nastavku (tabela 6):
Tabela 6
| NaCl + KCl | 0,5 |
| CaCl2 | 0,15 |
| BaCl2 | 0,01 |
| SO 4 2- | 0,01 |
| Fe2O3 | 0,006 |
| H2O | 1,0 |
| Nerastvorljivi ostatak | 0,015 |
Kalcijum... Šta znaš o tome? „To je metal“, to je sve što će mnogi odgovoriti. Koja jedinjenja kalcijuma postoje? Na ovo pitanje svi će početi da se češu po glavi. Da, o ovom poslednjem nema puno znanja, kao ni o samom kalcijumu. U redu, o tome ćemo kasnije, ali danas pogledajmo barem tri njegova spoja - kalcijum karbonat, hidroksid i kalcijum bikarbonat.
1. Kalcijum karbonat
To je sol koju čine kalcijum i ugljična kiselina. Formula ovog karbonata je CaCO 3.
Svojstva
Izgleda kao bijeli prah, nerastvorljiv u vodi i etil alkoholu.
Priprema kalcijum karbonata
Nastaje kalcizacijom kalcijum oksida. Potonjem se dodaje voda, a zatim se ugljični dioksid propušta kroz rezultirajuću otopinu. Produkti reakcije su željeni karbonat i voda, koji se lako odvajaju jedan od drugog. Ako se zagrije, doći će do cijepanja čiji će produkti biti ugljični dioksid, a kada se ovaj karbonat i ugljični monoksid (II) rastvore u vodi, može se dobiti kalcijum bikarbonat. Ako kombinirate ugljik i kalcijev karbonat, proizvodi ove reakcije će također biti ugljični monoksid.
Aplikacija
Ovaj karbonat je kreda, sa kojom se redovno susrećemo u školama i drugim osnovnim i visokoškolskim ustanovama. Takođe se koristi za beljenje plafona, farbanje stabala drveća u proleće i alkalizaciju tla u baštovanskoj industriji.
2. Kalcijum bikarbonat

Is Ima formulu Ca(HCO 3) 2.
Svojstva
Rastvara se u vodi, kao i svi hidrokarbonati. Međutim, on je neko vrijeme čini teškom. U živim organizmima kalcij-bikarbonat i neke druge soli sa istim ostatkom imaju funkciju regulacije postojanosti reakcija u krvi.
Potvrda
Dobija se interakcijom ugljičnog dioksida, kalcijum karbonata i vode.
Aplikacija
Nalazi se u vodi za piće, gdje njegova koncentracija može varirati - od 30 do 400 mg/l.
3. Kalcijum hidroksid

Formula - Ca(OH) 2. Ova supstanca je jaka baza. U raznim izvorima može se nazvati "puhom".
Potvrda
Nastaje kada reaguju kalcijum oksid i voda.
Svojstva
Ima izgled bijelog praha, slabo rastvorljivog u vodi. Kako se temperatura potonjeg povećava, numerička vrijednost rastvorljivosti opada. Takođe ima sposobnost da neutrališe kiseline; tokom ove reakcije nastaju odgovarajuće kalcijumove soli i voda. Ako joj dodate ugljen-dioksid rastvoren u vodi, dobijate istu vodu, a takođe i kalcijum karbonat. Kako se CO2 nastavlja, formirat će se kalcijum bikarbonat.
Aplikacija
Koristi se za krečenje prostorija, drvenih ograda, a takođe i za premazivanje rogova. Koristeći ovaj hidroksid, pripremaju se krečni malter, specijalna đubriva i silikatni beton, a uklanja se i karbonat (potonji se omekšava). Ova supstanca se koristi za kaustifikaciju kalijumovih i natrijum karbonata, dezinfekciju kanala korena zuba, tamnjenje kože i lečenje nekih biljnih bolesti. Kalcijum hidroksid je takođe poznat kao aditiv za hranu E526.
Zaključak
Shvaćate li zašto sam odlučio opisati ove tri supstance u ovom članku? Na kraju krajeva, ova jedinjenja se "susreću" jedni s drugima tokom razgradnje i proizvodnje svakog od njih. Postoje mnoge druge međusobno povezane supstance, ali o njima ćemo drugi put.
Oksidi
Kvarc(SiO2). Jednostavan oksid magmatskog porijekla, otporan na vremenske utjecaje. Kvarc se nalazi u kristalnom i kriptokristalnom obliku (čvrste zrnaste mase), kao i u izraslinama kristala (gorski kristal). Boja zrnastih masa kvarca varira: bezbojna, zadimljena, žuta. Sjaj je staklast, mastan na lomu. Rascjep je odsutan ili vrlo nesavršen, prijelom je konhoidalni. Transparent. Tvrdoća 7, gustina 2,65.
Razlikuju se sljedeće najvažnije sorte kristalnog kvarca: gorski kristal - bezbojan, proziran; ametist - ljubičasta; rauchtopaz – dimljeni, sivkasti ili smeđi; morion – crna; citrin - zlatno ili limun žuta. Kvarc se nalazi u granitima, pegmatitima, gnajsovima, škriljcima, pijesku i glini. Rastvara se samo u fluorovodoničnoj i fosfornoj kiselini. Ima četiri varijante - kalcedon, jaspis, kremen, ahat.
Kvarc se koristi u radiotehnici (piezoelektrični efekat), u nakitu, u optici, za proizvodnju izdržljivog stakla otpornog na vatru i kiseline.
Kalcedon(SiO2). Farbano u raznim bojama i nijansama: sivo (kalcedon); žuta, crvena, narandžasta (karneol); smeđe i smeđe (sarder); zelena (plazma); zelena jabuka zbog prisustva nikla (hrizopraza); zelena sa jarko crvenim mrljama (heliotrop) itd. Voštani sjaj, konhoidalni prelom, bez cepanja. Tvrdoća 6,5-7. Često formira pseudomorfe; poznate u sinterovanim oblicima.
Jasper(SiO 2, drevni naziv “jaspis”). Gusta sedimentna silikatna stijena. Sastoji se uglavnom od kalcedona i kvarca s primjesom željeznih oksida. Farbano u raznim bojama: crvena, zelena, žuta, crna, narandžasta, plavkasto-zelena itd. Tvrdoća 6-7, mat sjaj, neujednačen lom. Koristi se u umjetničkim i dekorativnim proizvodima.
Flint(SiO2). Sastoji se od 96-98% kalcedona. Ovo je kalcedon kontaminiran glinom i pijeskom. Boja je siva, smeđa i žuta. Sjaj je mat, nema dekoltea, prelom je konhoidan. Tvrdoća 2.5.
Ahat(SiO 2, oniks). Sastoji se od kalcedona. Ima različite kombinacije nijansi: crno-bijelo (oniks), smeđe i bijelo (sardoniks), crveno-bijelo (oniks karneol), sivo i bijelo (kalcedonks). Sjaj je voštan, dekolte je nesavršeno, lom je neujednačen. Tvrdoća 6,5-7. Koristi se u izradi preciznih instrumenata.
Korund(Al 2 O 3). Obično formira dobre bačvaste, piramidalne, stupaste i lamelarne kristale trigonalnog sistema. Ponekad formira kontinuirane zrnaste mase. Boja je obično plavkasta ili žućkasto-siva; ali postoje i prozirni kristali (plavi se zovu safiri, crveni se zovu rubini). Sjaj je staklast, nema dekoltea. Fino zrnate mase korunda nazivaju se šmirglom. Tvrdoća 9, gustina 3,95-4,1.
Korund se ponekad nalazi u magmatskim stijenama i pegmatitima, ali obično nastaje metamorfnim procesima u krečnjacima i glinovitim stijenama. Široko se koristi kao abraziv u metaloprerađivačkoj industriji, za obradu optičkog stakla i u rezanju kamena. Rubini i safiri su drago kamenje.
Magnetit(Fe 3 O 4). Kompleksni oksid (FeO Fe 2 O 3). Često se nalazi u kristalima dobro oktaedarskog oblika, ali obično raspoređeni u kontinuiranim zrnatim masama i kao inkluzije u magmatskim stijenama. Boja žuto-crna, crna pruga. Sjaj je polumetalni, neproziran. Bez cijepanja, vrlo magnetna. Tvrdoća 5,5-6,5, gustina 4,9-5,2.
Magnetit se formira u redukcionim uslovima i nalazi se u širokom spektru naslaga i tipova stena. Koristi se kao željezna ruda. Gvožđe sadrži 72%.
Hematit(Fe 2 O 3, crvena željezna ruda). Ime dolazi od grčke riječi "heme" - krv. Javlja se u obliku čvrstih gustih zrnastih i ljuskastih masa, ponekad u obliku tabličnih kristala. Boja varira od crvene do tamno crvene i crne. Traka je trešnja crvena. Sjaj je polumetalni, nema dekoltea. Tvrdoća 5,5-6,5, gustina 4,9-5,3. Nastaje pod istim uslovima kao i magnetit. koristi se kao ruda za željezo. Gvožđe sadrži oko 70%.
Hidroksidi
Boksit(Al 2 O 3 ·nH 2 O). Ime je dato po selu Beau u Provansi (Francuska). Sastoji se od nekoliko minerala hidrargilita Al(OH) 3 , dijaspore i bomita AlO(OH), kao i kaolinita, silicijum dioksida i željeznih oksida. Stoga se boksit mora smatrati stijenom sedimentnog porijekla. Boja je često crvena, smeđa, rjeđe ružičasta, bijela. Sjaj je mat, struktura je amorfna, lom je zemljan. Tvrdoća je 1-3, kod najgušćih varijanti dostiže 6. Porijeklo je egzogeno. Boksit je ruda za proizvodnju aluminijuma.
Limonit(2Fe 2 O 3 3H 2 O, smeđa željezna ruda). Obično sadrži nečistoće SiO 2 i fosfora. Ime je dobio po grčkoj riječi "limun" - livada (livada, močvarne rude). Nalazi se u neprekidnim sunđerastim masama u obliku naslaga i u zemljanim masama. Boja naslaga je tamno smeđa do skoro crna, zemljane varijante su oker žute i smeđe žute; pruga je žućkasto-braon.
Limonit je mješavina zemljanih minerala getita (HFeO2) i lepidokrocita (FeOOH), a bliži je i sedimentnim stijenama. Tvrdoća 1 - za labave i zemljane sorte, do 5 - za guste sorte, gustina 2,7-4,3. Porijeklo je egzogeno. Nastaje tokom razgradnje minerala koji sadrže gvožđe, kao i u obliku hemijskih i biohemijskih padavina na dnu jezera i priobalnih mora. Limonit se koristi kao ruda za željezo i za proizvodnju okera - podloge za vodene i uljane boje.
Opal(SiO 2 nH 2 O). U prijevodu sa sanskrita, "upola" znači dragi kamen. Čvrsti silika-hidrogel sa sadržajem vode do 3-9%, amorfan. Obično formira sinterovane guste mase i čini skelete i školjke nekih organizama (dijatomeja, radiolarija, itd.). bezbojan, ali zbog nečistoća može biti obojen u žutu, smeđu, crvenu, zelenu i crnu boju. Translucentni, konhoidalni prijelom. Tvrdoća 5,5, gustina 1,9-2,3. Sjaj stakla. Nastaje tokom trošenja silikata i aluminosilikata, a akumulira se i na morskom dnu kao rezultat biološke aktivnosti morskih organizama. Sekvence opoksa, tripolisa, dijatomita i radiolarita sastoje se uglavnom od opala. Postoji drveni opal (okamenjeno drvo) - pseudomorf opala na drvetu. Koristi se kao ukrasni i dragi kamen, kao abraziv za poliranje metala, kamena, kao i za izradu filtera, vatrostalne cigle, keramike itd.
Karbonati
To uključuje oko 80 minerala soli ugljene kiseline (H 2 CO 3), koji čine oko 1,7% mase zemljine kore.
Kalcit(CaCO 3, krečnjak). Kristalizira u obliku romboedra i skalenoedra, ali se češće nalazi u obliku različitih zrnastih, zemljanih agregata i sinter oblika. Boja je mlečno bijela, žućkasta, siva, ponekad ružičasta i plava. Staklo sjajno, prozirno. Tvrdoća 3, gustina 2,7. Dekolte je savršen. Burno ključa sa HCl, oslobađajući CO2. Prozirni, bezbojni kristali kalcita (romboedri) nazivaju se islandski špart. Oni su dvolomni.
Kalcit nastaje pretežno iz vodenih otopina, kako anorganski (tufovi) tako i biogeno (vapnenci). To je zbog procesa kemijskog trošenja i aktivnosti morskih biljaka i beskičmenjaka.
Kalcit pomešan sa mineralom gline formira slojeve lapora. Podzemne vode transportuju značajne mase kalcijum bikarbonata, formirajući bizarne sinterovane oblike kalcita u pećinama u obliku stalaktita i stalagmita. Tokom metamorfizma krede, krečnjaka i lapora formiraju se slojevi mermera koji se uglavnom sastoje od kalcita.
Praktična upotreba kalcita je vrlo raznolika: koristi se kao građevinski i ukrasni materijal, kao fluks u metalurgiji. Islandska šparta se koristi u optici.
Dolomit(CaMg 2). Ime je dato u čast francuskom mineralogu Dolomieru. Obično se nalazi u gustim mramornim masama i vrlo rijetko u kristalima. Farbano u bijeloj, žutoj i sivoj boji. Dekolte su savršene u tri smjera. Tvrdoća 3,5-4, gustina 2,8-2,9. Sjaj stakla. Reaguje sa HCl u prahu. Nastaje egzogeno u vodenim bazenima kao produkt promjene kalcita pod utjecajem otopina magnezija.
Koristi se kao građevinski i obložni kamen, kao vatrostalni materijal i kao fluks u metalurgiji za proizvodnju magnezijum karbonata.
Siderit(FeCO 3 , gvozdeni špart). Ime dolazi od grčke riječi "sideros" - željezo. Formira čvrste mramorne agregate i sferne nodule, a nalazi se iu obliku kristalnih izraslina. Boja je siva, smeđa, blago boje graška. Sjaj je staklast, dekolte savršen. Tvrdoća 3,5-4,5, gustina 3,7-3,9. Reaguje sa HCl kada se zagreje. Nastaje i tokom endogenog procesa (satelit sulfida) i tokom egzogenih procesa (čvorići i sferni čvorići u sedimentnim stijenama). Koristi se kao ruda za željezo.
Fosfati
Oni uključuju oko 350 minerala soli ortofosforne kiseline (H 3 PO 4) i čine oko 1% mase zemljine kore.
Apatit(Ca 5 3 (F,Cl)). Ime dolazi od grčke riječi "apato" - lažem, jer se dugo vremena pogrešno smatralo drugim mineralima. Kristalizuje se u heksagonalnom sistemu u tabličnim heksagonalnim, prizmatičnim i igličastim kristalima. Često formira kontinuirane mase zrnasto-kristalne strukture. Boja bijela, zelena, plava, žuta, smeđa, ljubičasta, ponekad bezbojna. Sjaj je staklast, lomljiv. Prijelom je neujednačen, dekolte je nesavršeno. Tvrdoća 5, gustina 3.2. Porijeklo je endogeno; velike akumulacije apatitnih ruda se javljaju u glavnim magmatskim stijenama.
Koristi se kao đubrivo, u proizvodnji šibica i u keramičkoj industriji.
Fosforit njegov sastav je sličan apatitu. Sadrži veliku količinu nečistoća u obliku kvarca, gline, kalcita, oksida i hidroksida željeza i aluminija, te organskih tvari. Po sastavu je bliži sedimentnim stijenama. Javlja se u obliku nodula, raznih pseudomorfoza na raznim organskim ostacima, u obliku nodula, ploča, slojeva. Struktura je amorfna. Boja crna, tamno siva, siva, smeđa, žućkastosmeđa. Mat sjaj. Tvrdoća 5. Kada se trlja, emituje miris sumpora, belog luka ili spaljene kosti. Porijeklo je egzogeno. Koristi se kao fosforno đubrivo.
Laboratorija 4
Silikati
Silikati su izuzetno rasprostranjeni minerali u prirodi, često vrlo složenog hemijskog sastava. Oni čine oko trećinu svih poznatih minerala i oko 75-80% mase čitave zemljine kore. Mnogi silikati su najvažniji minerali za stvaranje stijena, mnogi su vrijedne mineralne sirovine (smaragdi, topazi, akvamarini, azbest, kaolin itd.). Rendgenskim studijama je utvrđeno da je glavna strukturna jedinica svih silikata silicijum-kiseonički tetraedar 4-, u centru se nalazi silicijum, a na četiri vrha se nalaze joni kiseonika.
U zavisnosti od prirode artikulacije i lokacije silicijum-kiseonika tetraedara, razlikuju se vrste struktura: ostrvske, prstenaste, lančane (pirokseni), trakaste (amfiboli) i okvirne silikate (feldspati, feldspatidi). Formiranje silikata povezano je s endogenim procesima, uglavnom s kristalizacijom rashladnih magmatskih talina.
Ostrvski silikati
Ovi silikati se nazivaju ostrvskim silikatima jer se ion silicijuma nalazi u centru, "na ostrvu", okružen sa četiri jona kiseonika. slobodne valencije su zamijenjene metalnim katjonima Ca, Mg, K, Na, Al itd. Ostrvski silikati mogu imati i složenije radikale spajanjem nekoliko tetraedara jedan s drugim putem kisika.
Olivine((Mg,Fe) 2 , peridot). Ime potiče od maslinasto zelene boje minerala. Kristalizuje se u rombičnom sistemu. Dobro oblikovani kristali su rijetki, češće se nalaze u zrnatim agregatima. Boja može varirati od svijetlo žute do tamnozelene i crne, ali su česti i bezbojni, potpuno prozirni kristali. Sjaj je staklast, dekolte je nesavršeno. Prijelom je konhoidan i lomljiv. Tvrdoća 6,5-7, gustina 3,3-3,5. Poreklo je endogeno. Nalazi se u ultramafičnim (duniti, peridotiti) i mafičnim (gabro, dijabaz i bazalt) magmatskim stijenama. Nestabilan, raspada se sa stvaranjem minerala: serpentina, azbesta, talka, oksida gvožđa, hidroliskuna, magnezita itd.
Za izradu vatrostalnih opeka koriste se stijene sa niskim sadržajem željeza čistog olivina. Prozirni kristali olivina prelijepe zelene boje (peridoti) koriste se kao drago kamenje.
Granate. Ime dolazi od latinske riječi “granum” - zrno, a također i od njegove sličnosti sa zrncima ploda nara. Oni objedinjuju široku grupu minerala kubnog sistema sa karakterističnim izgledom kristala - lijepo fasetiranih poliedara (rombični dodekaedri, ponekad u kombinaciji sa tetragon-trioktaedrima). Razne boje (osim plave). Sjaj stakla. Linija je bijela ili svijetle boje u različitim nijansama. Dekolte je nesavršeno. Tvrdoća 6,5-7,5, gustina 3,5-4,2. Najrasprostranjeniji su:
Pirop – Mg 3 Al 2 3 tamnocrvena, ružičasta crvena, crna;
Almandin – Fe 3 Al 2 3 crvena, smeđe-crvena, crna;
Spessartine – Mn 3 Al 2 3 tamnocrvena, narandžasto-braon, smeđa;
Grossular – Ca 3 Al 2 3 bakarnožuta, blijedo zelena, smeđa, crvena;
Andradit – Ca 3 Fe 2 3 žuta, zelenkasta, smeđe-crvena, siva;
Uvarovite – Ca 3 Cr 2 3 smaragdno zelena.
Granati nastaju tokom metamorfizma (u kristalnim škriljcima), u kontaktu silicijumske magme sa karbonatnim stenama, a ponekad i u magmatskim stenama. Zbog hemijske otpornosti, često se pretvaraju u placer. Prozirne sorte almandina, piropa i andradita koriste se kao drago kamenje. Neprozirni granati se koriste u abrazivnoj industriji.
Topaz(Al(OH,F) 2). Naziv minerala dolazi od imena ostrva Topazos u Crvenom moru. Kristalizuje se u rombičnom sistemu. Nalazi se u prizmatičnim kristalima sa savršenim cijepanjem. Kristali su obično bezbojni ili obojeni plavo, ružičasto i žuto. Tvrdoća 8, gustina 3,4-3,6 kristali su obično bezbojni ili obojeni plavo, roze i žuto. nov, piropi, andraditi se koriste kao drago kamenje. Sjaj stakla. Nalazi se u kiselim magmatskim stijenama i pegmatitima. Lako se transformišu u placer.
Topaz se koristi kao materijal za oblikovanje i kao materijal za potporno kamenje, potisne ležajeve i druge dijelove preciznih instrumenata. Prozirni topazi rezani su poput dragog kamenja.
Sphen(CaTi×O, titanit). Na grčkom, "sfen" znači klin, jer su kristali klinastog oblika. Boja smeđa, smeđa, zlatna. Dijamantski sjaj. Tvrdoća 5.5. Porijeklo je endogeno i metamorfno. Koristi se kao ruda titanijuma.
Silikati prstena
Silicijum-kiseonički tetraedri su povezani u prstenove od tri, četiri, šest tetraedara.
Turmalin((Na, Ca) (Mg, Al)). Kristalizuje u trigonalnom sistemu u obliku izduženih prizmi. Boja je tamnozelena, crna, smeđa, ružičasta, plava, postoje bezbojne sorte. Sjaj je staklast, nema dekoltea. Tvrdoća 7-7,5, gustina 2,98-3,2. Nalazi se u granitima, pegmatitima, kao iu škriljcima i kontaktnim zonama sa magmatskim stijenama. Koristi se u elektrotehnici (piezoelektrični efekat) i u nakitu.
Beryl(Be 2 Al 2 ). Singonija je heksagonalna, nalazi se u heksagonalnim prizmama. Boja je žućkasta i smaragdno zelena, plava, plavkasta, rijetko ružičasta. Plavkasto-zelene sorte nazivaju se akvamarinima, a smaragdnozelene sorte zovu se smaragdi. Tvrdoća 7,5 – 8, gustina 2,6 – 2,8. Najčešće se nalazi u pegmatitima, a ponekad i u granitima (greisenima). Koriste se u nakitu, izradi instrumenata, za proizvodnju berilija, u proizvodnji raketa i aviona.
Lančani silikati
Lančani silikati nazivaju se pirokseni i čine važnu grupu minerala koji stvaraju stijene. Njihovi tetraedri su povezani u lance.
Augite(Ca,Na (Mg, Fe, Al) 2 O 6). Ime dolazi od grčke riječi "avge" - sjaj. Javlja se u kristalima kratkih stubova i nepravilnim zrnima. Boja crna, zelenkasta i smeđe-crna. Traka je siva ili sivkasto-zelena. Sjaj je staklast, dekolte prosječan. Tvrdoća 6,5, gustina 3,3 – 3,6. To je glavni mineral koji stvara stijene za osnovne i ultrabazične magmatske stijene. Kada se istroši, razlaže se, formirajući talk, kaolin, limonit.
Silikati trake
Silikati trake nazivaju se amfiboli. Njihov sastav i struktura su složeniji od onih u piroksenima. U vrpcastim silikatima tetraedri su povezani u dvostruke lance. Zajedno sa piroksenima, oni čine oko 15% mase zemljine kore.
Hornblende((Ca, Na) 2 (Mg, Fe, Al, Mn, Ti) 5 2 (OH, F) 2). kristalizira u dugim prizmatičnim stupčastim kristalima, ponekad agregatima vlaknaste ili igličaste strukture. Boja je zelena u različitim nijansama, od smeđe-zelene do crne. Linija je bijela sa zelenkastom nijansom. Sjaj je staklast, dekolte savršen. Prijelom je rascjepkan. Tvrdoća 5,5 – 6, gustina 3,1 – 3,5. Nalazi se u magmatskim metamorfnim (škriljevci, gnajsi, amfiboliti) stijenama. Kada izdrži, razlaže se, formirajući limonit, opal i karbonate.
Actinolite(Ca 2 (Mg, Fe) 5 2 2). Nalazi se u dugim prizmatičnim kristalima u obliku igle. Karakteristični su iglično-zračeći agregati. Boja je boca zelena u raznim nijansama, dekolte je savrseno. Tvrdoća 5,5 – 6, gustina 3,1 – 3,3. Često nastaju tokom metamorfizma krečnjaka, dolomita i osnovnih magmatskih stijena. Komponenta je mnogih škriljaca. Ponekad formira vlaknaste mase (amfibolni azbest) i formira ukrasni kamen žad. Koristi se kao ukrasni i obložni kamen.
Silikati listova
Odlikuju se vrlo savršenim cijepanjem u jednom smjeru, zbog čega se cijepaju u tanke elastične listove. Kristaliziraju se u monoklinskom sistemu, najčešće u obliku tableta, listova i prizmi. Tetraedri su povezani neprekidnim slojem u jednoj ravni. Formula uključuje (OH), tako da su prethodno bili klasifikovani kao vodni silikati. Osim silicija i kisika, njihov sastav uključuje K, Na, Al i Ca - elemente koji povezuju slojeve jedni s drugima. U zavisnosti od hemijskog sastava, dele se na talk-serpentinske, liskune, hidroliskuse i minerale gline.
Talk(Mg 3, 2, wen). Ime dolazi od arapske riječi “talg” - wen. Kamen sastavljen od talka naziva se lonac. Kristalizira se u monoklinalnom sistemu u obliku gustih masa, lisnatih agregata sa vrlo savršenim cijepanjem u jednom smjeru. Boja je svijetlozelena do bijela, ponekad žućkasta. Mekana, masna na dodir. Tvrdoća 1, gustina 2,6. Poreklo je metamorfno, kada se zagreva, tvrdoća se povećava na 6. Često sačinjava škriljce od talka. Nastaje u gornjim horizontima zemljine kore kao rezultat djelovanja vode i ugljičnog dioksida na stijene bogate magnezijem (peridotiti, pirokseniti, amfiboliti). Koristi se u industriji papira, gume, parfema, kože, farmaceutskoj i porculanskoj industriji, kao i za proizvodnju vatrostalnog posuđa i cigle.
Serpentine(Mg 6, kalem). "Serpintaria" je s latinskog prevedena kao serpentina (slično boji zmijske kože). koji se nalaze u kriptokristalnim agregatima. Boja je žuto-zelena, tamnozelena, do smeđe-crna sa žutim mrljama. Masni voštani sjaj. tvrdoća 2,5 – 4. Serpentin od finih vlakana sa svilenkastim sjajem naziva se azbest (planinski lan). “Azbest” na grčkom znači nezapaljiv. Nastaje od olivina kao rezultat djelovanja hidrotermalnih otopina na ultrabazične i karbonatne stijene (metamorfni proces serpentinizacije). Nestabilan, raspada se u karbonate i opal.
Koristi se kao obložni i ukrasni kamen, a azbestna vlakna se koriste za proizvodnju vatrootpornih tkanina, ponekad i kao magnezijumsko gnojivo.
Moskovljanin(KAl 2 2, kalijum liskun). Ime dolazi od drevnog italijanskog naziva za Moskovija (Moskovska država). Iz Moskovije u 16-17 vijeku. Izvozili su se listovi muskovita pod nazivom „moskovsko staklo“. Obično formira tablične ili lamelarne kristale heksagonalnog ili rombičnog presjeka. Bezbojan, ali često sa žućkastom, sivkastom, zelenkastom i rijetko crvenkastom nijansom. Sjaj je staklast, na ravnima dekoltea je sedefast i srebrnast. Tvrdoća 2 – 3, gustina 2,76 – 3,10. Porijeklo je endogeno i metamorfno. Javlja se kao mineral koji stvara stijene u kiselim magmatskim stijenama i kristalnim škriljcima (pjesak liskuna).
Cijenjen zbog svojih visokih električnih izolacijskih kvaliteta. Koristi se u kondenzatorima, reostatima, telefonima, magnetima, električnim lampama, generatorima, transformatorima itd. Njegova vatrostalna svojstva omogućavaju upotrebu muskovita za prozore u pećima za topljenje, oči u pećima, kao i za proizvodnju filca, umjetničkih tapeta, papira, boja i maziva.
Osim muskovita, nalaze se biotit (crni liskun), flagopit (smeđi, smeđi liskun), hidromica (tvorbe između liskuna i gline) i glaukonit.
Kaolinit(Al 4 8, porculanska zemlja). Ime dolazi od planine Kau Ling u Kini, gdje je ovaj mineral prvi put iskopan. Leži u rastresitim zemljanim masama, glavna je komponenta glina, a također je dio laporaca i škriljaca. Boja je bijela sa žućkastom ili sivkastom nijansom. Linija je bela, prelom je zemljan, dekolte je veoma savršeno u jednom pravcu. Mat sjaj, tvrdoća 1. Masna na dodir, prlja ruke. Nastaje tokom trošenja feldspata, liskuna i drugih aluminosilikata i javlja se u slojevima debljine i do nekoliko desetina metara. Koristi se u građevinarstvu, elektroizolaciji, keramičkoj, papirnoj industriji, u proizvodnji linoleuma, boja.
Montmorilonit((Al 2 Mg) 3 3 ×nH 2 O). Ime je dobilo po lokaciji u Montmorillonu (Francuska). Javlja se u neprekidnim zemljanim masama i rasprostranjen je u glinovitim sedimentnim stijenama. Boja bijela, roze, siva u zavisnosti od nečistoća. Masno na dodir, dekolte vrlo savršeno. Tvrdoća 1 – 2. Nastaje u procesu hemijskog trošenja osnovnih magmatskih stijena (gabro, bazalti). Kao i pepeo i tufovi. Dobar adsorbent. Koristi se u naftnoj, tekstilnoj i drugim industrijama.
Okvirni silikati
Okvirni silikati su aluminosilikati, jer je aluminijum uključen u radikal. Tetraedri u okvirnim silikatima imaju kontinuiranu koheziju. Okvirni silikati zauzimaju oko 50% mase zemljine kore. Odlikuje ih visoka tvrdoća (6 – 6,5), savršeno cijepanje u 2 smjera i staklast sjaj. Okvirni silikati se dijele u dvije grupe - feldspars I feldspatids. Feldspars se, pak, dijele na kalijum feldspat(ortoklaz i mikroklinal) i natrijum-kalcijum(plagioklasi).
Ortoklas(K, ravno probušena). Prevedeno sa grčkog orthos - ravan; klasis – cijepanje. Kristalizuje u monoklinskom sistemu. Nalazi se u prizmatičnim kristalima. Boja je žućkasta, ružičasta, bijela, smećkasta i mesocrvena; linija je bijela. Dekolte je savršeno u dva pravca koja se seku pod pravim uglom. Tvrdoća 6, gustina 2,56. Dio je kiselih i srednjih magmatskih stijena. Kada se vremenski razloži, razlaže se u glinu.
Tačka topljenja - 145°C. Koristi se u industriji porculana i keramike, kao iu proizvodnji stakla.
Microcline. U smislu formule i fizičkih svojstava, ne razlikuje se od ortoklasa. U prevodu sa grčkog, mikroklina znači "odstupio", jer ugao između ravni cepanja odstupa od prave linije za 20". Kristalizuje se u triklinskom sistemu. Pored kalijuma, obično sadrži određenu količinu natrijuma. Može se razlikovati iz ortoklasa samo pod mikroskopom.Koristi se kao i ortoklas, sa izuzetkom amazonita (zeleni ili zelenkastoplavi) koji se koristi u dekorativne svrhe.
Plagioklasi(sodium-calcium spars) predstavljaju binarni niz izomorfnih mješavina, u kojima su ekstremni članovi čisti soda plagioklas - albit i čisti kalcijum - anortit. Preostali članovi serije su numerisani na osnovu procenta anortita. U ovom slučaju, Na i Si su zamijenjeni Ca i Al i obrnuto. Naziv dolazi od grčke riječi "plagioklas" - koso cijepanje, jer se ravni cijepanja razlikuju od pravog ugla za 3,5 - 4°.
Albit – sadržaj Na anortita 0 do 10
Oligoklas 10 – 30
Andesine 30 – 50
Labrador 50 – 70
Bitovnit 70 – 90
Anortit – oko 90 – 100
Tako labrador, na primjer, nema formulu. Sadrži od 50 do 70% anortita i, shodno tome, 50-30% albita. Njegov broj može biti 50, 51, 52...70. Sadržaj silicijum oksida opada od albita do anortita, pa se albit i oligoklas nazivaju kiselim, andezin se naziva srednjim, a labradorit, bytownit i anortit se nazivaju bazičnimi.
Svi plagioklasi kristališu u triklinskom sistemu. Dobro oblikovani kristali su relativno rijetki i imaju tabelarni ili tabelarno-prizmatični izgled. Često se javljaju u obliku čvrstih finokristalnih agregata. Albit, aligoklas i labradorit mogu se identificirati po vanjskim karakteristikama, a ostatak se može odrediti hemijskom analizom i mikroskopom.
Boja plagioklasa je bijela, sivkasta ponekad sa zelenkastom, plavičastom i rjeđe crvenkastom nijansom, cijepanje je savršeno. Sjaj stakla. Tvrdoća 6 – 6,5; gustina se povećava sa 2,61 (albit) na 2,76 (anortit). Nalazi se u magmatskim stenama od felzita do mafica.
Albit(N / A). Ime dolazi od latinske riječi "albus", što znači bijeli. Tvrdoća 6, sjaj stakla, bela boja. Dekolte je savršeno, prijelom je neujednačen. Koristi se kao obložni i ukrasni kamen. Kada se istroši, pretvara se u kaolinit.
Labrador. Ime je dobio po poluostrvu Labrador u Sjevernoj Americi, gdje se nalaze labradoriti (stene sastavljene od labradorita). Boja je često tamno siva, sjaj je staklast, pruga je bijela. Dekolte je savršen. Dobro je uglačan, ima iridescentnost - daje zelene, plave i ljubičaste tonove na ravnima dekoltea. Koristi se u industriji nakita i kao obložni i ukrasni kamen. Vremenske prilike do minerala gline.
Feldspatids. Imaju strukturu okvira. Njihov hemijski sastav je sličan feldspatu, ali sadrže manje silicijumske kiseline.
Nefelin(Na – uljni kamen). Od grčke riječi "nepheli" - oblak. Kristalizira u heksagonalnom sistemu, formirajući prizmatične kratkostubne kristale, ali se češće javlja u obliku kontinuiranih krupnozrnih masa. Boja žućkasto-siva, zelenkasta, smeđe-crvena. Sjaj je mastan. Nema dekoltea. Tvrdoća 5.5. Nalazi se u nefelinskim sijenitima i alkalnim pegmatitima. Sirovina je za industriju keramike i stakla, kao i za proizvodnju aluminijuma.
Leucit(Ka). "Leikos" na grčkom znači svetlost. Formira karakteristične poliedarske kristale (tetragon-trioktaedre), slične kristalima granata. Boja je bijela sa sivkastom i žućkastom nijansom ili pepeljasto siva. Sjaj je staklast, prelom je konhoidan, nema dekoltea. Tvrdoća 5 – 6, gustina 2,5. Javlja se u efuzivnim stijenama, često u velikim količinama. Služi kao sirovina za proizvodnju aluminijumskih i potašnih đubriva.
Zeoliti. Svijetlo obojeni, često bijeli minerali su aluminosilikati natrijuma i kalcija. Sadrže veliku količinu vode, koja se lako oslobađa pri zagrijavanju bez uništavanja kristalne rešetke minerala. U poređenju sa bezvodnim aluminosilikatima, zeoliti se odlikuju manjom tvrdoćom i nižom specifičnom težinom. Lakše se razgrađuje. Nastaju na niskim temperaturama i nalaze se zajedno sa kalcitom i kalcedonom. Često ispunjavaju praznine u mehurastoj lavi i od velike su važnosti u procesima tla.
Laboratorija 5
Kamenje
Stene su geološki nezavisni delovi zemljine kore manje ili više stalnog hemijskog i mineraloškog sastava, koji se razlikuju po određenoj strukturi, fizičkim svojstvima i uslovima nastanka.
Stijene mogu biti monomineralne ili polimineralne. Monomineralne stijene se sastoje od jednog minerala (gips, labradorit). Polimineralne stijene se sastoje od nekoliko minerala. Granit se, na primjer, sastoji od kvarca, feldspata, liskuna, rogova i drugih minerala.
Na osnovu porijekla, sve stijene se obično dijele u tri grupe: magmatske, sedimentne i metamorfne. Magmatske i metamorfne stijene čine oko 95% mase zemljine kore, a sedimentne stijene samo 5%, ali je njihova uloga vrlo velika. Prekrivaju oko 75% ukupne zemljine površine, na njima se formiraju tla i predstavljaju temelje za objekte u izgradnji.
Magmatske stijene
Magmatske stijene nastaju kao rezultat hlađenja vatrenih tečnih stijena - magme. Prema uslovima formiranja, magmatske stijene se dijele na intruzivne stijene koje su se stvrdnule u utrobi zemlje i efuzijske stijene koje su se stvrdnule na površini zemlje. Duboke stijene dijele se na duboke stijene, ili ponorske (dubine veće od 5 km), i poluduboke, ili hipobisalne (od 5 km i bliže površini zemlje) i prelazne su od intruzivnih do efuzivnih stijena.
Uslovi za formiranje intruzivnih i efuzivnih stijena značajno se razlikuju jedni od drugih, što utiče na strukturu stijene koju karakterizira struktura i tekstura. Ispod struktura razumiju karakteristike unutrašnje strukture stijene u zavisnosti od stepena kristalizacije minerala koji su u njoj sastavni, veličine zrna i njihovog oblika.
Na osnovu stepena kristalizacije, strukture se dijele na potpuno kristalne, djelomično kristalne i staklaste.
1. Zrnast(puna kristala) se dijeli na krupno-, srednje- i sitnozrna. Stijena se sastoji od zrna minerala koji su čvrsto pritisnuti jedno uz drugo. Karakteristično za duboke stijene (graniti, sijeniti, gabri) itd.
2. Nekristalni(pirokristalna) - stijena zrna se ne formira (vulkanski tuf).
3. Djelomično kristalno. U ovim stijenama na pozadini staklaste mase ističu se manje-više sitni kristali (mikroliti). Tipično za eruptivne i neke poluduboke stijene (trahiti, porfiri, andeziti) itd.
4. Kriptokristalni. Zrna su vidljiva samo pod mikroskopom (bazalt, dijabaz).
Na osnovu relativne veličine kristalnih zrna, strukture se razlikuju kao jednozrnate, nejednakozrnate i porfiritne.
5. Porfirije. Kristali pojedinih minerala oštro se ističu svojom veličinom na pozadini sitnozrnate ili staklaste mase. Inkluzije su desetine puta veće veličine od zrna glavne mase stijene (porfirit, trahit). Ponekad izolovani porfirni strukture kada su inkluzije samo dva do tri puta veće od veličine glavnih zrna.
6. Dijabaz(u obliku igle). Ovu strukturu karakterizira prisustvo izduženih kristala. U osnovi, ova struktura je svojstvena dijabazu, ali postoje dijabazi sa strukturom porfira.
7. Stakleni. Posebnost staklaste strukture je da se eruptirana lava smrzava na površini prije nego što ima vremena da se kristalizira. Obsidijan i plovućac imaju ovu strukturu sa karakterističnim staklastim sjajem i konhoidnom frakturom.
Na osnovu oblika mineralnih zrna razlikuju se i brojne strukture: aplit, gabro, granit itd.
Ispod teksture razumjeti posebnost vanjske strukture stijene, koju karakterizira lokacija mineralnih zrna, njihova orijentacija i boja. Na osnovu rasporeda zrna u stijeni razlikuju se masivne i pjegave teksture, a kod eruptiranih stijena – fluidne.
1. Masivno(monolitni). Odlikuje se ujednačenim rasporedom minerala u stijenskoj masi - svi dijelovi stijene su isti (opsidijan, dijabaz, bazalt, granit).
2. Spotted. Karakterizira ga neravnomjerna raspodjela svijetlih i tamnih minerala u zapremini stijene (porfiriti).
3. Fluidal. Karakteristično za eruptirane stijene staklaste strukture, povezane s protokom lave (tragovi toka).
4. Porozno. Karakteristična je i za eruptirane stijene i uzrokovana je oslobađanjem plinova iz očvrsnute lave (vulkanski tuf, plovućac).
5. Slate. Karakteristika metamorfnih stijena. Zrna takvih tekstura su spljoštena i smještena paralelno jedno s drugim (škriljci).
Klasifikacija magmatskih stijena, osim njihovog porijekla, zasniva se na njihovim hemijskim karakteristikama ili mineraloškom sastavu. Do sada se koristila hemijska klasifikacija Levinson-Lessing, prema kojoj su sve magmatske stijene podijeljene ovisno o sadržaju SiO 2 u magmi u četiri grupe: kisele (65 - 75%), srednje (52 - 65%) , osnovni (40 - 52).%) i ultrabazični (manje od 40%). Magmatske stijene su različito raspoređene u zemljinoj kori. Tako graniti i lipariti čine 47%, andeziti – 24%, bazalti – 21%, a sve ostale magmatske stijene – samo 8% (tabela 1).
Tabela 1 – Klasifikacija magmatskih stijena
| Grupa | Nametljivo (duboko) | Efuzivan (izliven) | Minerali | |
| Main | Minor | |||
| 1. Ultra-acid | Pegmatit (u obliku vena) | - | Kvarc, feldspat | Liskun, topaz, volframit |
| 2. Kiselo | Granit Pegmatite | Liparit Obsidian Pumice | Kvarc, kalijum feldspat, kiseli plagioklas, biotit, muskovit, rogova, pirokseni | Apatit, cirkon, magnetit, turmalin |
| 3. Srednji | Diorite | Andezit | Srednji plagioklasi, rogovi, biotit, pirokseni | Kvarc, kalijum feldspat, apatit, titanit, magnetit |
| Sienit | Trachyte | Kalijum feldspat, rogova, kiseli plagioklas, biotit, pirokseni | Kvarc, titanit, cirkon | |
| 4. Osnovni | Gabro labradorit | Bazalt dijabaz | Osnovni plagioklasi, pirokseni, olivin, rogovi, biotit | Ortoklas, kvarc, apatit, magnetit, titanit |
| 5. Ultrabasic | Dunit Peridotit Piroksenit | - | Olivin, pirokseni, rogovi | Magnetit, ilmenit, kromit, pirotin |
Kiselo kamenje