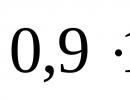Fizička i hemijska svojstva baza. Hemijska svojstva baza Opšta hemijska svojstva baza
baze (hidroksidi)– složene supstance čije molekule sadrže jednu ili više hidroksi OH grupa. Najčešće se baze sastoje od atoma metala i OH grupe. Na primjer, NaOH je natrijum hidroksid, Ca(OH) 2 je kalcijum hidroksid, itd.
Postoji baza - amonijum hidroksid, u kojoj je hidroksi grupa vezana ne za metal, već za NH 4 + ion (amonijum kation). Amonijev hidroksid nastaje kada se amonijak otopi u vodi (reakcija dodavanja vode u amonijak):
NH 3 + H 2 O = NH 4 OH (amonijum hidroksid).
Valencija hidroksi grupe je 1. Broj hidroksilnih grupa u osnovnoj molekuli zavisi od valencije metala i jednak joj je. Na primjer, NaOH, LiOH, Al (OH) 3, Ca(OH) 2, Fe(OH) 3, itd.
Svi razlozi -čvrste materije koje imaju različite boje. Neke baze su visoko rastvorljive u vodi (NaOH, KOH, itd.). Međutim, većina njih nije rastvorljiva u vodi.
Baze rastvorljive u vodi nazivaju se alkalije. Alkalne otopine su "sapunaste", klizave na dodir i prilično jetke. Alkalije uključuju hidrokside alkalnih i zemnoalkalnih metala (KOH, LiOH, RbOH, NaOH, CsOH, Ca(OH) 2, Sr(OH) 2, Ba(OH) 2 itd.). Ostali su nerastvorljivi.
Nerastvorljive baze- to su amfoterni hidroksidi, koji u interakciji s kiselinama djeluju kao baze, a ponašaju se kao kiseline s alkalijama.
Različite baze imaju različite sposobnosti uklanjanja hidroksi grupa, pa se dijele na jake i slabe baze.
Jake baze u vodenim rastvorima lako odustaju od svojih hidroksi grupa, ali slabe baze ne.
 Hemijska svojstva baza
Hemijska svojstva baza
Hemijska svojstva baza karakteriziraju njihove veze s kiselinama, anhidridima kiselina i solima.
1. Djelujte prema indikatorima. Indikatori mijenjaju boju ovisno o interakciji s različitim hemikalijama. U neutralnim rastvorima imaju jednu boju, u kiselim rastvorima drugu boju. U interakciji s bazama mijenjaju svoju boju: indikator metil narandže postaje žut, lakmus indikator postaje plav, a fenolftalein postaje fuksija.
2. Reakcija s kiselim oksidima sa stvaranje soli i vode:
2NaOH + SiO 2 → Na 2 SiO 3 + H 2 O.
3. Reaguje sa kiselinama, formiranje soli i vode. Reakcija baze s kiselinom naziva se reakcija neutralizacije, jer nakon njenog završetka medij postaje neutralan:
2KOH + H 2 SO 4 → K 2 SO 4 + 2H 2 O.
4. Reaguje sa solima formiranje nove soli i baze:
2NaOH + CuSO 4 → Cu(OH) 2 + Na 2 SO 4.
5. Kada se zagriju, mogu se razgraditi na vodu i glavni oksid:
Cu(OH) 2 = CuO + H 2 O.
Imate još pitanja? Želite saznati više o fondacijama?
Za pomoć od tutora -.
Prva lekcija je besplatna!
blog.site, pri kopiranju materijala u cijelosti ili djelimično, potrebna je veza do originalnog izvora.
DEFINICIJA
Razlozi nazivaju se elektroliti, pri čijoj se disocijaciji od negativnih iona formiraju samo OH - joni:
Fe(OH) 2 ↔ Fe 2+ + 2OH - ;
NH 3 + H 2 O ↔ NH 4 OH ↔ NH 4 + + OH - .
Sve neorganske baze dijele se na vodotopive (alkalije) - NaOH, KOH i nerastvorljive u vodi (Ba(OH) 2, Ca(OH) 2). U zavisnosti od ispoljenih hemijskih svojstava, među bazama se razlikuju amfoterni hidroksidi.
Hemijska svojstva baza
Kada indikatori djeluju na otopine neorganskih baza, njihova boja se mijenja, pa kada baza uđe u otopinu, lakmus postaje plav, metilnarandžasta žuta, a fenolftalein grimiz.
Anorganske baze mogu reagirati s kiselinama da tvore sol i vodu, a baze nerastvorljive u vodi reagiraju samo s kiselinama topivim u vodi:
Cu(OH) 2 ↓ + H 2 SO 4 = CuSO 4 +2H 2 O;
NaOH + HCl = NaCl + H 2 O.
Baze koje su nerastvorljive u vodi su termički nestabilne, tj. kada se zagriju, podvrgavaju se razgradnji da tvore okside:
2Fe(OH) 3 = Fe 2 O 3 + 3 H 2 O;
Mg(OH) 2 = MgO + H 2 O.
Alkalije (baze rastvorljive u vodi) reaguju sa kiselim oksidima i formiraju soli:
NaOH + CO 2 = NaHCO 3.
Alkalije su također sposobne ući u reakcije interakcije (ORR) s nekim nemetalima:
2NaOH + Si + H 2 O → Na 2 SiO 3 +H 2.
Neke baze ulaze u reakcije razmjene sa solima:
Ba(OH) 2 + Na 2 SO 4 = 2NaOH + BaSO 4 ↓.
Amfoterni hidroksidi (baze) također pokazuju svojstva slabih kiselina i reagiraju sa alkalijama:
Al(OH) 3 + NaOH = Na.
Amfoterne baze uključuju aluminij i cink hidrokside. hrom (III) itd.
Fizička svojstva baza
Većina baza su čvrste materije koje variraju u rastvorljivosti u vodi. Alkalije su u vodi rastvorljive baze koje su najčešće bijele čvrste tvari. Baze koje nisu rastvorljive u vodi mogu imati različite boje, na primer, gvožđe (III) hidroksid je smeđa čvrsta supstanca, aluminijum hidroksid je bijela čvrsta supstanca, a bakar (II) hidroksid je plava čvrsta supstanca.
Dobivanje osnova
Baze se pripremaju na različite načine, na primjer, reakcijom:
- razmjena
CuSO 4 + 2KOH → Cu(OH) 2 ↓ + K 2 SO 4 ;
K 2 CO 3 + Ba(OH) 2 → 2KOH + BaCO 3 ↓;
— interakcije aktivnih metala ili njihovih oksida s vodom
2Li + 2H 2 O→ 2LiOH +H 2;
BaO + H 2 O → Ba(OH) 2 ↓;
— elektroliza vodenih rastvora soli
2NaCl + 2H 2 O = 2NaOH + H 2 + Cl 2.
Primjeri rješavanja problema
PRIMJER 1
| Vježbajte | Izračunajte praktičnu masu aluminijum oksida (prinos ciljnog proizvoda je 92%) iz reakcije raspadanja aluminijum hidroksida težine 23,4 g. |
| Rješenje | Napišimo jednačinu reakcije: 2Al(OH) 3 = Al 2 O 3 + 3H 2 O. Molarna masa aluminijum hidroksida, izračunata pomoću tabele hemijskih elemenata D.I. Mendeljejev – 78 g/mol. Nađimo količinu aluminijum hidroksida: v(Al(OH) 3) = m(Al(OH) 3)/M(Al(OH) 3); v(Al(OH) 3) = 23,4/78 = 0,3 mol. Prema jednadžbi reakcije v(Al(OH) 3): v(Al 2 O 3) = 2:1, dakle, količina supstance aluminijum oksida biće: v(Al 2 O 3) = 0,5 × v(Al(OH) 3); v(Al 2 O 3) = 0,5 × 0,3 = 0,15 mol. Molarna masa aluminijum oksida, izračunata pomoću tabele hemijskih elemenata D.I. Mendeljejev – 102 g/mol. Nađimo teorijsku masu aluminijevog oksida: m(Al 2 O 3) th = 0,15×102 = 15,3 g. Tada je praktična masa aluminijum oksida: m(Al 2 O 3) pr = m(Al 2 O 3) th × 92/100; m(Al 2 O 3) pr = 15,3 × 0,92 = 14 g. |
| Odgovori | Težina aluminijum oksida - 14 g. |
PRIMJER 2
| Vježbajte | Izvršite niz transformacija: Fe→ FeCl 2 → Fe(OH) 2 →Fe(OH) 3 →Fe(NO 3) 3 |
Savremena hemijska nauka predstavlja mnogo različitih grana, a svaka od njih, pored svoje teorijske osnove, ima veliki primenjeni i praktični značaj. Šta god da dodirnete, sve oko vas je hemijski proizvod. Glavne sekcije su neorganska i organska hemija. Hajde da razmotrimo koje su glavne klase supstanci klasifikovane kao neorganske i koja svojstva imaju.
Glavne kategorije neorganskih jedinjenja
To uključuje sljedeće:
- Oksidi.
- Sol.
- Grounds.
- Kiseline.
Svaka od klasa je predstavljena širokim spektrom spojeva neorganske prirode i važna je u gotovo svakoj strukturi ljudske ekonomske i industrijske aktivnosti. Sva glavna svojstva karakteristična za ova jedinjenja, njihovu pojavu u prirodi i njihovu proizvodnju izučavaju se u školskom kursu hemije bez greške, od 8. do 11. razreda.
Postoji opšta tabela oksida, soli, baza, kiselina, koja predstavlja primere svake supstance i njihovog agregacionog stanja i pojave u prirodi. Prikazane su i interakcije koje opisuju hemijska svojstva. Međutim, razmotrit ćemo svaku od klasa posebno i detaljnije.
Grupa spojeva - oksidi
4. Reakcije usljed kojih elementi mijenjaju CO
Me +n O + C = Me 0 + CO
1. Reagens voda: stvaranje kiselina (izuzetak SiO 2)
CO + voda = kiselina
2. Reakcije sa bazama:
CO 2 + 2CsOH = Cs 2 CO 3 + H 2 O
3. Reakcije sa bazičnim oksidima: stvaranje soli
P 2 O 5 + 3MnO = Mn 3 (PO 3) 2
4. OVR reakcije:
CO 2 + 2Ca = C + 2CaO,
Pokazuju dvostruka svojstva i međusobno djeluju po principu acido-bazne metode (sa kiselinama, alkalijama, bazičnim oksidima, kiselinskim oksidima). Ne stupaju u interakciju sa vodom.
1. Sa kiselinama: stvaranje soli i vode
AO + kiselina = so + H 2 O
2. Sa bazama (alkalijama): formiranje hidrokso kompleksa
Al 2 O 3 + LiOH + voda = Li
3. Reakcije sa kiselim oksidima: dobijanje soli
FeO + SO 2 = FeSO 3
4. Reakcije sa OO: stvaranje soli, fuzija
MnO + Rb 2 O = dvostruka sol Rb 2 MnO 2
5. Reakcije fuzije sa alkalijama i karbonatima alkalnih metala: stvaranje soli
Al 2 O 3 + 2LiOH = 2LiAlO 2 + H 2 O
Svaki viši oksid, formiran od metala ili nemetala, kada se otopi u vodi, daje jaku kiselinu ili lužinu.
Organske i neorganske kiseline
U klasičnom zvuku (na osnovu pozicija ED - elektrolitičke disocijacije - kiseline su jedinjenja koja u vodenoj sredini disociraju na katjone H+ i anjone kiselinskih ostataka An -. Međutim, danas su kiseline pažljivo proučavane u bezvodnim uslovima, pa postoje mnogo različitih teorija za hidrokside.
Empirijske formule oksida, baza, kiselina, soli sastoje se samo od simbola, elemenata i indeksa koji ukazuju na njihovu količinu u tvari. Na primjer, neorganske kiseline se izražavaju formulom H + kiselinski ostatak n-. Organske supstance imaju drugačiju teorijsku reprezentaciju. Pored empirijske, za njih možete zapisati punu i skraćenu strukturnu formulu, koja će odražavati ne samo sastav i količinu molekule, već i poredak atoma, njihovu međusobnu povezanost i glavnu funkciju. grupa za karboksilne kiseline -COOH.
U anorganskim tvarima sve kiseline se dijele u dvije grupe:
- bez kiseonika - HBr, HCN, HCL i drugi;
- koji sadrže kiseonik (oksokiseline) - HClO 3 i sve gde ima kiseonika.
Anorganske kiseline se također klasificiraju prema stabilnosti (stabilne ili stabilne - sve osim ugljične i sumporne, nestabilne ili nestabilne - ugljične i sumporne). Po jačini kiseline mogu biti jake: sumporne, hlorovodonične, azotne, perhlorne i druge, kao i slabe: sumporovodične, hipohlorne i druge.

Organska hemija ne nudi istu raznolikost. Kiseline koje su organske prirode klasifikuju se kao karboksilne kiseline. Njihova zajednička karakteristika je prisustvo -COOH funkcionalne grupe. Na primjer, HCOOH (mravlji), CH 3 COOH (sirćetna), C 17 H 35 COOH (stearinska) i drugi.
Postoji niz kiselina koje se posebno pažljivo naglašavaju kada se ova tema razmatra u školskom kursu hemije.
- Solyanaya.
- Nitrogen.
- Orthophosphoric.
- Bromovodična.
- Ugalj.
- Vodonik jodid.
- Sumporna.
- Sirćet ili etan.
- Butan ili ulje.
- Benzoin.
Ovih 10 kiselina u hemiji su osnovne supstance odgovarajuće klase kako u školskom kursu tako i uopšte u industriji i sintezi.

Svojstva neorganskih kiselina
Glavna fizička svojstva uključuju, prije svega, različito stanje agregacije. Na kraju krajeva, postoji niz kiselina koje u normalnim uslovima imaju oblik kristala ili praha (borne, ortofosforne). Velika većina poznatih anorganskih kiselina su različite tekućine. Tačke ključanja i topljenja također variraju.
Kiseline mogu izazvati teške opekotine, jer imaju moć da unište organsko tkivo i kožu. Indikatori se koriste za otkrivanje kiselina:
- metilnarandžasta (u normalnom okruženju - narandžasta, u kiselinama - crvena),
- lakmus (u neutralnom - ljubičasta, u kiselinama - crvena) ili neki drugi.
Najvažnija hemijska svojstva uključuju sposobnost interakcije sa jednostavnim i složenim supstancama.
| Sa čime su u interakciji? | Primjer reakcije |
1. Sa jednostavnim supstancama - metalima. Obavezni uslov: metal mora biti u EHRNM prije vodonika, jer metali koji stoje poslije vodonika nisu u stanju da ga istisnu iz sastava kiselina. Reakcija uvijek proizvodi vodonik i sol. | |
2. S razlozima. Rezultat reakcije su sol i voda. Takve reakcije jakih kiselina sa alkalijama nazivaju se reakcijama neutralizacije. | Bilo koja kiselina (jaka) + rastvorljiva baza = so i voda |
| 3. Sa amfoternim hidroksidima. Zaključak: sol i voda. | 2HNO 2 + berilijum hidroksid = Be(NO 2) 2 (srednja so) + 2H 2 O |
| 4. Sa osnovnim oksidima. Rezultat: voda, sol. | 2HCL + FeO = željezo (II) hlorid + H 2 O |
| 5. Sa amfoternim oksidima. Konačni efekat: sol i voda. | 2HI + ZnO = ZnI 2 + H 2 O |
6. Sa solima koje nastaju slabijim kiselinama. Konačni efekat: sol i slaba kiselina. | 2HBr + MgCO 3 = magnezijum bromid + H 2 O + CO 2 |
Kada su u interakciji s metalima, ne reagiraju sve kiseline jednako. Hemija (9. razred) u školi uključuje vrlo plitko proučavanje ovakvih reakcija, međutim, i na ovom nivou se razmatraju specifična svojstva koncentrirane dušične i sumporne kiseline u interakciji s metalima.
Hidroksidi: alkalije, amfoterne i nerastvorljive baze
Oksidi, soli, baze, kiseline - sve ove klase tvari imaju zajedničku kemijsku prirodu, što se objašnjava strukturom kristalne rešetke, kao i međusobnim utjecajem atoma u molekulima. Međutim, ako je bilo moguće dati vrlo specifičnu definiciju za okside, onda je to teže učiniti za kiseline i baze.
Baš kao i kiseline, baze su, prema teoriji ED, supstance koje se u vodenom rastvoru mogu razgraditi na metalne katjone Me n + i anjone hidroksilnih grupa OH - .
- Rastvorljive ili alkalije (jake baze koje se mijenjaju Formirane od metala grupa I i II. Primjer: KOH, NaOH, LiOH (tj. uzimaju se u obzir elementi samo glavnih podgrupa);
- Slabo rastvorljiv ili nerastvorljiv (srednje jačine, ne menjati boju indikatora). Primer: magnezijum hidroksid, gvožđe (II), (III) i drugi.
- Molekularne (slabe baze, u vodenom okruženju reverzibilno se disociraju u molekule jona). Primjer: N 2 H 4, amini, amonijak.
- Amfoterni hidroksidi (pokazuju dvojna svojstva bazične kiseline). Primjer: berilij, cink i tako dalje.

Svaka predstavljena grupa se izučava u školskom kursu hemije u odeljku „Osnove“. Hemija u razredima 8-9 uključuje detaljno proučavanje alkalija i slabo rastvorljivih jedinjenja.
Glavna karakteristična svojstva baza
Sve alkalije i slabo rastvorljiva jedinjenja nalaze se u prirodi u čvrstom kristalnom stanju. Istovremeno, njihove temperature topljenja su obično niske, a slabo topljivi hidroksidi se raspadaju kada se zagrijavaju. Boja baza je drugačija. Ako su alkalije bijele, onda kristali slabo topljivih i molekularnih baza mogu biti vrlo različitih boja. Rastvorljivost većine jedinjenja ove klase može se naći u tabeli koja predstavlja formule oksida, baza, kiselina, soli i pokazuje njihovu rastvorljivost.
Alkalije mogu promijeniti boju indikatora na sljedeći način: fenolftalein - grimizna, metilnarandžasta - žuta. To se osigurava slobodnim prisustvom hidrokso grupa u otopini. Zato slabo rastvorljive baze ne daju takvu reakciju.
Hemijska svojstva svake grupe baza su različita.
| Hemijska svojstva | ||
| Alkalije | Slabo rastvorljive baze | Amfoterni hidroksidi |
I. Interakcija s CO (rezultat - sol i voda): 2LiOH + SO 3 = Li 2 SO 4 + voda II. Interakcija sa kiselinama (sol i voda): obične reakcije neutralizacije (vidi kiseline) III. Oni stupaju u interakciju sa AO kako bi formirali hidrokso kompleks soli i vode: 2NaOH + Me +n O = Na 2 Me +n O 2 + H 2 O, ili Na 2 IV. Oni stupaju u interakciju s amfoternim hidroksidima i formiraju hidroksi kompleksne soli: Isto kao i sa AO, samo bez vode V. Reaguje sa rastvorljivim solima da nastane nerastvorljivi hidroksidi i soli: 3CsOH + željezo (III) hlorid = Fe(OH) 3 + 3CsCl VI. Reaguje sa cinkom i aluminijumom u vodenoj otopini da nastane soli i vodik: 2RbOH + 2Al + voda = kompleks sa hidroksid ionom 2Rb + 3H 2 | I. Kada se zagreju, mogu se razgraditi: nerastvorljivi hidroksid = oksid + voda II. Reakcije s kiselinama (rezultat: sol i voda): Fe(OH) 2 + 2HBr = FeBr 2 + voda III. Interakcija s KO: Me +n (OH) n + KO = so + H 2 O | I. Reaguje sa kiselinama da nastane so i voda: (II) + 2HBr = CuBr 2 + voda II. Reakcija sa alkalijama: rezultat - sol i voda (stanje: fuzija) Zn(OH) 2 + 2CsOH = sol + 2H 2 O III. Reakcija s jakim hidroksidima: rezultat su soli ako se reakcija odvija u vodenoj otopini: Cr(OH) 3 + 3RbOH = Rb 3 |
Ovo su većina hemijskih svojstava koje pokazuju baze. Hemija baza je prilično jednostavna i prati opšte zakone svih neorganskih jedinjenja.
Klasa neorganskih soli. Klasifikacija, fizička svojstva
Na osnovu odredbi ED, soli se mogu nazvati anorganskim jedinjenjima koja se u vodenom rastvoru disociraju na metalne katjone Me +n i anjone kiselih ostataka An n-. Ovako možete zamisliti soli. Hemija daje više od jedne definicije, ali ova je najtačnija.
Štaviše, prema svojoj hemijskoj prirodi, sve soli se dijele na:
- Kiseli (sadrže vodikov kation). Primjer: NaHSO 4.
- Basic (sadrži hidrokso grupu). Primjer: MgOHNO 3, FeOHCL 2.
- Srednji (sastoje se samo od metalnog kationa i kiselinskog ostatka). Primjer: NaCL, CaSO 4.
- Dvostruko (uključuje dva različita metalna kationa). Primjer: NaAl(SO 4) 3.
- Kompleks (hidrokso kompleksi, akva kompleksi i dr.). Primjer: K 2.
Formule soli odražavaju njihovu kemijsku prirodu, a također ukazuju na kvalitativni i kvantitativni sastav molekula.

Oksidi, soli, baze, kiseline imaju različita svojstva rastvorljivosti, što se može videti u odgovarajućoj tabeli.
Ako govorimo o stanju agregacije soli, onda moramo primijetiti njihovu ujednačenost. Postoje samo u čvrstom, kristalnom ili praškastom stanju. Raspon boja je prilično raznolik. Otopine složenih soli u pravilu imaju svijetle, zasićene boje.
Hemijske interakcije za klasu srednjih soli
Imaju slična hemijska svojstva kao baze, kiseline i soli. Oksidi se, kao što smo već ispitali, po ovom faktoru donekle razlikuju od njih.
Ukupno se mogu razlikovati 4 glavne vrste interakcija za srednje soli.
I. Interakcija sa kiselinama (samo jakim sa stanovišta ED) sa stvaranjem druge soli i slabe kiseline:
KCNS + HCL = KCL + HCNS
II. Reakcije sa rastvorljivim hidroksidima koje proizvode soli i nerastvorljive baze:
CuSO 4 + 2LiOH = 2LiSO 4 rastvorljiva so + Cu(OH) 2 nerastvorljiva baza
III. Reakcija sa drugom rastvorljivom soli da nastane nerastvorljiva i rastvorljiva so:
PbCL 2 + Na 2 S = PbS + 2NaCL
IV. Reakcije s metalima koji se nalaze u EHRNM lijevo od onog koji formira sol. U ovom slučaju, metal koji reaguje ne bi trebao stupiti u interakciju s vodom u normalnim uvjetima:
Mg + 2AgCL = MgCL 2 + 2Ag
Ovo su glavne vrste interakcija koje su karakteristične za srednje soli. Formule složenih, baznih, dvostrukih i kiselih soli same za sebe govore o specifičnosti prikazanih hemijskih svojstava.

Formule oksida, baza, kiselina, soli odražavaju kemijsku suštinu svih predstavnika ovih klasa anorganskih spojeva, a osim toga daju ideju o nazivu tvari i njenim fizičkim svojstvima. Stoga posebnu pažnju treba posvetiti njihovom pisanju. Općenito nevjerovatna kemijska nauka nudi nam ogroman izbor jedinjenja. Oksidi, baze, kiseline, soli - to je samo dio ogromne raznolikosti.
Opšta svojstva baza su određena prisustvom OH - jona u njihovim rastvorima, što stvara alkalnu sredinu u rastvoru (fenolftalein postaje grimiz, metilnarandžasta žuta, lakmus plava).
1. Hemijska svojstva alkalija:
1) interakcija sa kiselim oksidima:
2KOH+CO 2 ®K 2 CO 3 +H 2 O;
2) reakcija sa kiselinama (reakcija neutralizacije):
2NaOH+ H 2 SO 4 ®Na 2 SO 4 +2H 2 O;
3) interakcija sa rastvorljivim solima (samo ako, kada lužina deluje na rastvorljivu so, nastane talog ili se oslobađa gas):
2NaOH+ CuSO 4 ®Cu(OH) 2 ¯+Na 2 SO 4,
Ba(OH) 2 +Na 2 SO 4 ®BaSO 4 ¯+2NaOH, KOH(konc.)+NH 4 Cl (kristalni) ®NH 3 +KCl+H 2 O.
2. Hemijska svojstva nerastvorljivih baza:
1) interakcija baza sa kiselinama:
Fe(OH) 2 +H 2 SO 4 ®FeSO 4 +2H 2 O;
2) raspadanje pri zagrevanju. Kada se zagriju, nerastvorljive baze se razlažu na osnovni oksid i vodu:
Cu(OH) 2 ®CuO+H 2 O
Kraj rada -
Ova tema pripada sekciji:
Atomske molekularne studije u hemiji. Atom. Molekul. Hemijski element. Mol. Jednostavne složene supstance. Primjeri
Atomska molekularna učenja u hemiji atom molekula hemijski element mol jednostavne složene supstance primeri.. teorijska osnova moderne hemije je atomska molekula.. atomi su najmanje hemijske čestice koje su granica hemikalije..
Ako vam je potreban dodatni materijal na ovu temu, ili niste pronašli ono što ste tražili, preporučujemo da koristite pretragu u našoj bazi radova:
Šta ćemo sa primljenim materijalom:
Ako vam je ovaj materijal bio koristan, možete ga spremiti na svoju stranicu na društvenim mrežama:
| Tweet |
Sve teme u ovoj sekciji:
Dobivanje osnova
1. Priprema alkalija: 1) interakcija alkalnih ili zemnoalkalnih metala ili njihovih oksida sa vodom: Ca+2H2O®Ca(OH)2+H
Nomenklatura kiselina
Nazivi kiselina su izvedeni od elementa od kojeg je kiselina nastala. Istovremeno, nazivi kiselina bez kiseonika obično imaju završetak -vodik: HCl - hlorovodonična, HBr - hidrobromo
Hemijska svojstva kiselina
Opšta svojstva kiselina u vodenim rastvorima određena su prisustvom H+ jona koji nastaju pri disocijaciji molekula kiselina, pa su kiseline donori protona: HxAn«xH+
Dobijanje kiselina
1) interakcija kiselih oksida sa vodom: SO3+H2O®H2SO4, P2O5+3H2O®2H3PO4;
Hemijska svojstva kiselih soli
1) kisele soli sadrže atome vodika koji mogu učestvovati u reakciji neutralizacije, pa mogu reagovati sa alkalijama, pretvarajući se u srednje ili druge kisele soli - sa manjim brojem
Dobijanje kiselih soli
Kisela so se može dobiti: 1) reakcijom nepotpune neutralizacije polibazne kiseline sa bazom: 2H2SO4+Cu(OH)2®Cu(HSO4)2+2H
Bazične soli
Bazne (hidrokso soli) su soli koje nastaju kao rezultat nepotpune zamjene hidroksidnih iona baze anionima kiseline. Pojedinačne kiselinske baze, npr. NaOH, KOH,
Hemijska svojstva bazičnih soli
1) bazične soli sadrže hidrokso grupe koje mogu sudjelovati u reakciji neutralizacije, pa mogu reagirati s kiselinama, pretvarajući se u intermedijarne soli ili bazične soli s manje
Priprema bazičnih soli
Glavna so se može dobiti: 1) reakcijom nepotpune neutralizacije baze sa kiselinom: 2Cu(OH)2+H2SO4®(CuOH)2SO4+2H2
Srednje soli
Srednje soli su produkti potpune zamjene H+ jona kiseline ionima metala; mogu se smatrati i produktima potpune zamjene OH jona baznog anjona
Nomenklatura srednjih soli
U ruskoj nomenklaturi (koja se koristi u tehnološkoj praksi) postoji sljedeći redoslijed imenovanja srednjih soli: riječ se dodaje u korijen imena kiseline koja sadrži kisik
Hemijska svojstva srednjih soli
1) Gotovo sve soli su jonska jedinjenja, pa se u topljeni i u vodenom rastvoru disociraju na ione (kada se struja propušta kroz rastvore ili rastaljene soli, dolazi do procesa elektrolize).
Priprema srednjih soli
Većina metoda za dobijanje soli zasniva se na interakciji supstanci suprotne prirode - metala sa nemetalima, kiselih oksida sa baznim, baza sa kiselinama (vidi tabelu 2).
Atomska struktura
Atom je električki neutralna čestica koja se sastoji od pozitivno nabijenog jezgra i negativno nabijenih elektrona. Atomski broj elementa u periodnom sistemu elemenata jednak je naboju jezgra
Sastav atomskih jezgara
Jezgro se sastoji od protona i neutrona. Broj protona jednak je atomskom broju elementa. Broj neutrona u jezgru jednak je razlici masenog broja izotopa i
Elektron
Elektroni rotiraju oko jezgra u određenim stacionarnim orbitama. Krećući se duž svoje orbite, elektron ne emituje niti apsorbuje elektromagnetnu energiju. Dolazi do emisije ili apsorpcije energije
Pravilo za popunjavanje elektronskih nivoa i podnivoa elemenata
Broj elektrona koji mogu biti na jednom energetskom nivou određen je formulom 2n2, gdje je n broj nivoa. Maksimalno punjenje prva četiri nivoa energije: za prvi
Energija jonizacije, afinitet elektrona, elektronegativnost
Energija jonizacije atoma. Energija potrebna za uklanjanje elektrona iz nepobuđenog atoma naziva se prva energija ionizacije (potencijal) I: E + I = E+ + e- Energija ionizacije
Kovalentna veza
U većini slučajeva, kada se formira veza, dijele se elektroni vezanih atoma. Ova vrsta hemijske veze naziva se kovalentna veza (prefiks "co-" na latinskom
Sigma i pi veze
Sigma (σ)-, pi (π)-veze - približan opis tipova kovalentnih veza u molekulima različitih jedinjenja, σ-veza se odlikuje činjenicom da je gustina elektronskog oblaka maksimalna
Formiranje kovalentne veze mehanizmom donor-akceptor
Pored homogenog mehanizma formiranja kovalentne veze iznesenog u prethodnom odeljku, postoji i heterogeni mehanizam - interakcija suprotno nabijenih jona - protona H+ i
Hemijska veza i molekularna geometrija. BI3, PI3
Slika 3.1 Dodatak dipolnih elemenata u molekule NH3 i NF3
Polarna i nepolarna veza
Kovalentna veza nastaje kao rezultat dijeljenja elektrona (za formiranje zajedničkih elektronskih parova), što se događa tokom preklapanja elektronskih oblaka. U obrazovanju
Jonska veza
Jonska veza je kemijska veza koja nastaje elektrostatičkom interakcijom suprotno nabijenih jona. Dakle, proces obrazovanja i
Oksidacijsko stanje
Valencija 1. Valencija je sposobnost atoma hemijskih elemenata da formiraju određeni broj hemijskih veza. 2. Vrijednosti valencije variraju od I do VII (rijetko VIII). Valens
Vodikova veza
Pored raznih heteropolarnih i homeopolarnih veza, postoji još jedna posebna vrsta veze koja je privukla sve veću pažnju hemičara u protekle dve decenije. Ovo je takozvani vodonik
Kristalne rešetke
Dakle, kristalnu strukturu karakteriše pravilan (pravilan) raspored čestica na strogo određenim mestima u kristalu. Kada mentalno povežete ove tačke sa linijama, dobijate razmake.
Rješenja
Ako se kristali kuhinjske soli, šećera ili kalijevog permanganata (kalijev permanganat) stave u posudu s vodom, tada možemo vidjeti kako se količina čvrste tvari postepeno smanjuje. Istovremeno, voda
Elektrolitička disocijacija
Otopine svih supstanci mogu se podijeliti u dvije grupe: elektroliti provode električnu struju, neelektroliti ne provode električnu struju. Ova podjela je uslovna, jer sve
Mehanizam disocijacije
Molekuli vode su dipolni, tj. jedan kraj molekula je negativno nabijen, drugi je pozitivno. Molekul ima negativan pol koji se približava jonu natrijuma, a pozitivan pol koji se približava jonu hlora; surround io
Jonski proizvod vode
Vodikov indeks (pH) je vrijednost koja karakterizira aktivnost ili koncentraciju vodikovih jona u otopinama. Indikator vodonika je označen kao pH. Indeks vodika je numerički
Hemijska reakcija
Hemijska reakcija je transformacija jedne supstance u drugu. Međutim, takvoj definiciji je potreban jedan značajan dodatak. U nuklearnom reaktoru ili akceleratoru neke tvari se također pretvaraju
Metode raspoređivanja koeficijenata u OVR
Metoda elektronske ravnoteže 1). Zapisujemo jednačinu hemijske reakcije KI + KMnO4 → I2 + K2MnO4 2). Pronalaženje atoma
Hidroliza
Hidroliza je proces izmjenske interakcije između jona soli i vode, koji dovodi do stvaranja blago disociranih tvari i praćen promjenom reakcije (pH) medija. Suština
Brzina hemijskih reakcija
Brzina reakcije je određena promjenom molarne koncentracije jednog od reaktanata: V = ± ((C2 – C1) / (t2 - t
Faktori koji utiču na brzinu hemijskih reakcija
1. Priroda supstanci koje reaguju. Priroda hemijskih veza i struktura molekula reagensa igraju važnu ulogu. Reakcije se odvijaju u pravcu razaranja manje jakih veza i stvaranja supstanci sa
Energija aktivacije
Sudar hemijskih čestica dovodi do hemijske interakcije samo ako čestice koje se sudaraju imaju energiju koja prelazi određenu vrednost. Hajde da razmotrimo jedni druge
Katalizator
Mnoge reakcije se mogu ubrzati ili usporiti uvođenjem određenih supstanci. Dodate supstance ne učestvuju u reakciji i ne troše se tokom njenog toka, ali imaju značajan uticaj na
Hemijska ravnoteža
Hemijske reakcije koje se odvijaju uporedivim brzinama u oba smjera nazivaju se reverzibilne. U takvim reakcijama nastaju ravnotežne smjese reagensa i proizvoda čiji sastav
Le Chatelierov princip
Le Chatelierov princip kaže da da biste pomaknuli ravnotežu udesno, prvo morate povećati pritisak. Zaista, kako se pritisak povećava, sistem će se „opreti“ povećanju kon
Faktori koji utječu na brzinu kemijske reakcije
Faktori koji utiču na brzinu hemijske reakcije Povećati brzinu Smanjiti brzinu Prisustvo hemijski aktivnih reagensa
Hesov zakon
Korištenje vrijednosti tablice
Toplotni efekat
Tokom reakcije, veze u polaznim supstancama se kidaju i stvaraju se nove veze u produktima reakcije. Budući da se stvaranje veze događa oslobađanjem, a njeno raskidanje dolazi do apsorpcije energije, tada x
1. Baza + kisela so + voda
KOH + HCl  KCl + H2O.
KCl + H2O.
2. Baza + kiselinski oksid  sol + voda
sol + voda
2KOH + SO 2  K 2 SO 3 + H 2 O.
K 2 SO 3 + H 2 O.
3. Alkali + amfoterni oksid/hidroksid  sol + voda
sol + voda
2NaOH (tv) + Al 2 O 3  2NaAlO 2 + H 2 O;
2NaAlO 2 + H 2 O;
NaOH (čvrsta) + Al(OH) 3  NaAlO 2 + 2H 2 O.
NaAlO 2 + 2H 2 O.

Reakcija izmjene između baze i soli odvija se samo u otopini (i baza i sol moraju biti topive) i samo ako je barem jedan od proizvoda talog ili slab elektrolit (NH 4 OH, H 2 O)
Ba(OH) 2 + Na 2 SO 4  BaSO4
BaSO4  + 2NaOH;
+ 2NaOH;
Ba(OH)2 + NH4Cl  BaCl 2 + NH 4 OH.
BaCl 2 + NH 4 OH.

Samo baze alkalnih metala sa izuzetkom LiOH su otporne na toplotu
Ca(OH)2  CaO + H 2 O;
CaO + H 2 O;
NaOH  ;
;
NH4OH  NH 3 + H 2 O.
NH 3 + H 2 O.

2NaOH (s) + Zn  Na 2 ZnO 2 + H 2 .
Na 2 ZnO 2 + H 2 .
KISELINE
Kiseline sa pozicije TED-a, nazivaju se složene supstance koje se disociraju u rastvorima dajući ion vodonika H+.
Klasifikacija kiselina
1. Prema broju atoma vodika koji se mogu eliminirati u vodenom rastvoru, kiseline se dijele na jednobazni(HF, HNO2), dibasic(H 2 CO 3, H 2 SO 4), tribasic(H3PO4).
2. Prema sastavu kiseline dijele se na bez kiseonika(HCl, H 2 S) i koji sadrže kiseonik(HClO 4, HNO 3).
3. Prema sposobnosti kiselina da se disociraju u vodenim rastvorima dele se na slab I jaka. Molekuli jakih kiselina u vodenim otopinama se potpuno raspadaju na ione i njihova je disocijacija nepovratna.
Na primjer, HCl  H + + Cl - ;
H + + Cl - ;
H2SO4  H++HSO
H++HSO  .
.
Slabe kiseline reverzibilno disociraju, tj. njihovi molekuli u vodenim rastvorima se delimično raspadaju na ione, a na višebazne - stepenasto.
CH 3 COOH  CH 3 COO - + H + ;
CH 3 COO - + H + ;
1) H2S  HS - + H + , 2) HS -
HS - + H + , 2) HS -  H + + S 2- .
H + + S 2- .
Dio molekule kiseline bez jednog ili više vodikovih jona H+ naziva se kiseli ostatak. Naboj kiselinskog ostatka je uvijek negativan i određen je brojem H+ iona uklonjenih iz molekula kiseline. Na primjer, ortofosforna kiselina H 3 PO 4 može formirati tri kisela ostatka: H 2 PO  - dihidrogen fosfat jon, HPO
- dihidrogen fosfat jon, HPO  - hidrogen fosfat jon, PO
- hidrogen fosfat jon, PO  - fosfatni jon.
- fosfatni jon.
Imena kiselina bez kiseonika sastavljena su dodavanjem završetka - vodik korenu ruskog naziva elementa koji formira kiselinu (ili nazivu grupe atoma, na primer, CN - - cijan): HCl - hlorovodonična kiselina (hlorovodonična kiselina), H 2 S - sulfidna kiselina, HCN - cijanovodonična kiselina (cijanovodična kiselina).
Nazivi kiselina koje sadrže kiseonik formiraju se i od ruskog naziva elementa koji stvara kiselinu uz dodatak riječi "kiselina". U ovom slučaju, naziv kiseline u kojoj je element u najvećem stepenu oksidacije završava se sa "... ova" ili "... ova", na primer, H 2 SO 4 je sumporna kiselina, H 3 AsO 4 je arsenska kiselina. Sa smanjenjem oksidacionog stanja elementa koji stvara kiselinu, završeci se mijenjaju u sljedećem slijedu: "...naya"(HClO 4 – perhlorna kiselina), "...ish"(HClO 3 – perhlorna kiselina), "...umoran"(HClO 2 – hlorna kiselina), "...jajasta"(HClO je hipohlorna kiselina). Ako element formira kiseline dok je u samo dva oksidaciona stanja, tada naziv kiseline koji odgovara najnižem oksidacionom stanju elementa dobija završetak "... čist" (HNO 3 - dušična kiselina, HNO 2 - dušična kiselina) .
Isti kiseli oksid (na primjer, P 2 O 5) može odgovarati nekoliko kiselina koje sadrže jedan atom danog elementa u molekuli (na primjer, HPO 3 i H 3 PO 4). U takvim slučajevima, nazivu kiseline koja sadrži najmanji broj atoma kiseonika u molekuli dodaje se prefiks “meta...”, a nazivu kiseline koja sadrži prefiks “orto...” najveći broj atoma kiseonika u molekulu (HPO 3 – metafosforna kiselina, H 3 PO 4 – ortofosforna kiselina).
Ako molekula kiseline sadrži nekoliko atoma elementa koji tvori kiselinu, tada se njenom imenu dodaje brojčani prefiks, na primjer, H 4 P 2 O 7 - dva fosforna kiselina, H 2 B 4 O 7 – četiri borna kiselina.
H 2 SO 5 H 2 S 2 O 8
S H – O – S –O – O – S – O – H
H-O-O  O O O
O O O
Peroxosulfuric acid Peroxosulfuric acid
Hemijska svojstva kiselina

HF + KOH  KF + H2O.
KF + H2O.

H2SO4 + CuO  CuSO 4 + H 2 O.
CuSO 4 + H 2 O.

2HCl + BeO  BeCl 2 + H 2 O.
BeCl 2 + H 2 O.

Kiseline stupaju u interakciju s otopinama soli ako to rezultira stvaranjem soli netopive u kiselinama ili slabije (hlapljive) kiseline u odnosu na izvornu kiselinu.
H2SO4 + BaCl2  BaSO4
BaSO4  +2HCl;
+2HCl;
2HNO3 + Na2CO3  2NaNO3 + H2O + CO2
2NaNO3 + H2O + CO2  .
.

H 2 CO 3  H 2 O + CO 2.
H 2 O + CO 2.

H 2 SO 4 (razrijeđen) + Fe  FeSO 4 + H 2;
FeSO 4 + H 2;
HCl + Cu  .
.
Slika 2 prikazuje interakciju kiselina sa metalima.
KISELINA - OKSIDIZATOR
Metal u naponskoj seriji nakon H 2
+ nema reakcije
nema reakcije
Metal u opsegu napona do N 2
+  metalna so + H 2
metalna so + H 2 
do minimalnog stepena
H 2 SO 4 koncentrovan
Au, Pt, Ir, Rh, Ta
oksidacija (s.o.)+
 nema reakcije
nema reakcije
/Mq/Zn
zavisno od uslova
Metalni sulfat u max s.o.
+
 + +
+ +
metal (ostalo)
+
 +
+
+
+
HNO 3 koncentriran
Au, Pt, Ir, Rh, Ta
+  nema reakcije
nema reakcije
Alkalni/zemnoalkalni metal
Metalni nitrat u max d.o.
Metal (ostali; Al, Cr, Fe, Co, Ni kada se zagrije)


 +
+
HNO 3 razrijeđen
Au, Pt, Ir, Rh, Ta
+  nema reakcije
nema reakcije
Alkalni/zemnoalkalni metal
NH 3 (NH 4 NO 3)
Nitratemetal
la in max s.o.
+  +
+
Metal (ostatak u dvorištu napona do N 2)
NO/N 2 O/N 2 /NH 3 (NH 4 NO 3)
zavisno od uslova
+

Metal (ostatak u nizu napona nakon H 2)

Fig.2. INTERAKCIJA KISELA SA METALIMA
SALT
soli – To su složene tvari koje se disociraju u otopinama i formiraju pozitivno nabijene ione (kationi - bazični ostaci), s izuzetkom vodikovih iona, i negativno nabijenih jona (anion - kiseli ostaci), osim hidroksidnih iona.