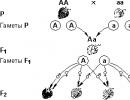
Defekti u prikazu fizike kristala. Defekti kristalnih rešetki. Defekti u kristalima

Defekti u kristalima se dijele na:
Nul-dimenzionalno
Jednodimenzionalni
Dvodimenzionalno

Tačkasti defekti (nul-dimenzionalni) - kršenje periodičnosti u tačkama rešetke izolovanim jedna od druge; u sve tri dimenzije ne prelaze jednu ili više međuatomskih udaljenosti (parametara rešetke). Tačkasti defekti su prazna mjesta, atomi u međuprostorima, atomi na mjestima “strane” podrešetke, atomi nečistoća u mjestima ili međuprostorima.

Slobodna radna mjesta– odsustvo atoma ili jona na mjestu kristalne rešetke; Implementirano ili međuprostorni atomi ili ioni mogu biti i unutrašnji i nečisti atomi ili ioni koji se razlikuju od glavnih atoma po veličini ili valentnosti. Supstitucijske nečistoće zamijeniti čestice glavne supstance u čvorovima rešetke.




Linearno(jednodimenzionalni) defekti – Glavni linearni defekti su dislokacije. A priori koncept dislokacija prvi su upotrijebili Orowan i Theiler 1934. godine u svom proučavanju plastične deformacije kristalnih materijala, kako bi objasnili veliku razliku između praktične i teorijske čvrstoće metala. Dislokacija– to su defekti u kristalnoj strukturi, a to su linije duž i blizu kojih je narušen ispravan raspored atomskih ravni karakterističnih za kristal.


Površinski defekti kristalne rešetke. Defekti površinske rešetke uključuju greške slaganja i granice zrna.


zaključak: Sve vrste defekata, bez obzira na uzrok njihovog nastanka, dovode do narušavanja ravnotežnog stanja rešetke i povećavaju njenu unutrašnju energiju.

Defekti u kristalima. Kristal je ispunjen nedostacima. Kako defekti utiču na čvrstoću kristala? One smanjuju snagu stotinama, hiljadama puta. Ali, kako se deformacija kristala povećava, tako se povećava i broj defekata u njemu. A pošto su defekti u interakciji jedni s drugima, što ih je više, to im je teže da se kreću u kristalu. Pokazalo se da je to paradoks: ako u kristalu postoji defekt, kristal se lakše deformiše i uništava nego ako nema defekta. A ako ima previše nedostataka, onda kristal ponovo postaje jak, a što je više nedostataka, to je uređeniji. To znači da ćemo, ako naučimo kontrolirati broj i lokaciju defekata, moći kontrolirati čvrstoću materijala.
Slajd 21 sa prezentacije "kristal". Veličina arhive sa prezentacijom je 1397 KB.Hemija 11. razred
sažetak druge prezentacije“Klasifikacija supstanci” - Klasifikacija supstanci. Jednostavne supstance - metali. Zlato. Zn. Sumpor. Klasifikacija supstanci. CO. Cl2. Metali i nemetali. Uklonite nepotrebno karakteristike klasifikacije supstance. Jednostavne supstance su nemetali. Na2o. O2. Srebro. O.S. Gabrielyan. 11. razred. Razvrstajte supstance u klase.
“Ciklus elemenata u prirodi” - Denitrificirajuće bakterije. Biljni proteini. Bakterije. Atmosfera. Munja. Ciklus azota. Veliki krug. Organizmi koji se raspadaju. Fosfor se nalazi u raznim mineralima kao što je neorganski fosfation (PO43-). Fosfor je dio gena i molekula koji prenose energiju unutar stanica. Dominantni oblik kiseonika u atmosferi je molekul O2. Umjetna fosfatna gnojiva; deterdženti. Fosfati su rastvorljivi u vodi, ali nisu isparljivi.
“Hemija disperznih sistema” - Disperzni sistem čvrsta - tečna. Porozna čokolada. Hrskavica. Smoke. Minerali. Medijum i faza su tečnosti. Keramika. Syneresis određuje rok trajanja prehrambenih, medicinskih i kozmetičkih gelova. U medicini. Gazirana pića. Disperzovani sistem gas - tečnost. Smog. IN Prehrambena industrija. Penasta guma. Zoli Geli. Prava rješenja. Polistiren. Suspenzije. Disperzovani sistem tečnost - gas. Gelovi. Faza i medij se lako odvajaju taloženjem.
“Periodični sistem hemije” - I. Döbereiner, J. Dumas, francuski hemičar A. Chancourtois, engleski. hemičari W. Odling, J. Mendeljejev o mjestu elementa u sistemu; Položaj elementa je određen periodom i brojevima grupe. predviđanje “ekaaluminijuma” (budući Ga, otkrio P. Lecoq de Boisbaudran 1875.), “ekaborona” (Sc, otkrio švedski naučnik L. Nilsson 1879.) i “ekasilicijuma” (Ge, otkrio njemački naučnik K. Winkler 1886.). 1829 - “trijade” Döbereinera 1850 “ diferencijalni sistemi» Pettenkofer i Dumas. 1864 Meyer - tabela koja pokazuje odnos atomskih težina za nekoliko karakterističnih grupa elemenata. Newlands - postojanje grupa elemenata sličnih u hemijska svojstva. Kolchina N. 11 "A". Periodični zakon, Periodni sistem hemijski elementi D. I. Mendeljejev.
“Higijenski i kozmetički proizvodi” - Kao deterdžent. Djelovanje druge grupe dezodoransa temelji se na djelomičnom suzbijanju procesa znojenja. Za umjetnike Vodikov peroksid u prahu. Značenje riječi. Kozmetički dekorativni puderi su višekomponentne mješavine. Kozmetički alati. Završila: Svetlana Šesterikova, učenica 11a, GOU srednje škole br. 186. Malo istorije. Faza I. Funkcije deterdženta. Sapuni i deterdženti.
"Srebrna hemija" - Srebrni nitrat, ili lapis - kristali rombičnog sistema. Bradavica nakon kauterizacije srebrnim nitratom. Srebro u umjetnosti. AgNO3 je veoma rastvorljiv. I koje opasnosti krije tajanstveni metal? Formira legure sa mnogim metalima. Većina soli srebra je slabo rastvorljiva u vodi, a sva rastvorljiva jedinjenja su toksična. Tehnologije za proizvodnju čistog metalnog srebra.
Defekti u kristalima su kršenja idealne kristalne strukture. Takvo kršenje može se sastojati u zamjeni atoma date supstance stranim atomom (atom nečistoće) (slika 1, a), u uvođenju dodatnog atoma u međuprostorno mjesto (slika 1, b), u odsustvu atoma u čvoru (slika 1, c). Takvi nedostaci se nazivaju tačka.Oni uzrokuju nepravilnosti u rešetki, koje se protežu na udaljenosti od nekoliko perioda.
Pored točkastih defekata, postoje defekti koncentrirani u blizini određenih linija. Oni se nazivaju linearni defekti ili dislokacije. Defekti ovog tipa remete ispravnu izmjenu kristalnih ravnina.
Najjednostavniji tipovi dislokacija su regionalni I vijak dislokacije.

Dislokacija ruba je uzrokovana ekstra kristalnom poluravninom umetnutom između dva susjedna sloja atoma (slika 2). Vijčana dislokacija se može predstaviti kao rezultat reza u kristalu duž poluravnine i naknadnog pomaka dijelova rešetke koji leže na suprotnim stranama reza jedan prema drugom za vrijednost jedne periode (slika 3).

Defekti imaju snažan uticaj na fizička svojstva kristali, uključujući njihovu snagu.
Prvobitno postojeća dislokacija, pod uticajem naprezanja stvorenih u kristalu, kreće se duž kristala. Pomicanje dislokacija je spriječeno prisustvom drugih defekata u kristalu, na primjer, prisustvom atoma nečistoća. Dislokacije se također usporavaju prilikom međusobnog ukrštanja. Povećanje gustoće dislokacija i povećanje koncentracije nečistoća dovodi do snažne inhibicije dislokacija i prestanka njihovog kretanja. Kao rezultat, povećava se čvrstoća materijala. Na primjer, povećanje čvrstoće željeza postiže se otapanjem atoma ugljika u njemu (čelik).
Plastična deformacija je praćena uništavanjem kristalne rešetke i stvaranjem velikog broja defekata koji sprečavaju kretanje dislokacija. Ovo objašnjava jačanje materijala tokom hladne obrade.
Slajd 1
fizika solidan. Dio 2.
Pravi kristali (baš kao i "pravi momci") su idealni kristali koji rastu na pogrešnim mjestima.

Slajd 2
Rast kristala Znate, naravno, da se voda (pri normalnom pritisku) smrzava na 0°. Ako temperatura padne, tada će tačno na 0° voda početi da se smrzava i pretvara u kristale leda. Dok se sva voda ne zamrzne, njena temperatura neće dalje pasti. Ako, naprotiv, zagrejete kristal leda na 0°, on će ostati nepromenjen. Čim temperatura dostigne 0°, kristal će se odmah početi topiti. Bez obzira koliko dalje zagrijavamo, temperatura leda se neće povećati dok se sav led ne otopi. Tek kada se cijeli kristal, otopljen, pretvori u vodu (drugim riječima, dok se struktura svih čestica ne raspadne), temperatura vode može početi rasti. Bilo koja kristalna tvar se topi i kristalizira na strogo određenoj tački topljenja: željezo - na 1530°, kalaj - na 232°, kvarc - na 1713°, živa - na minus 38°. Nekristalne čvrste materije nemaju konstantnu tačku topljenja (a samim tim ni temperaturu kristalizacije); kada se zagreju, postepeno omekšaju.

Slajd 3
Metode uzgoja kristala Jedna od njih je hlađenje zasićene vruće otopine. Na svakoj temperaturi ne može se otopiti više od određene količine tvari u određenoj količini otapala (na primjer, voda). Ako se otopina polako hladi, formira se nekoliko jezgara, koje postepeno rastu na sve strane pretvaraju se u prekrasne kristale pravilnog oblika. Brzim hlađenjem nastaju mnoge jezgre, a čestice iz otopine će "pasti" na površinu rastućih kristala, poput graška iz poderane vrećice; Naravno, to neće proizvesti prave kristale, jer čestice u otopini možda jednostavno neće imati vremena da se „slože“ na površinu kristala na svoje mjesto. Druga metoda za dobivanje kristala je postepeno uklanjanje vode iz zasićene otopine. "Višak" supstance kristališe. I u ovom slučaju, što sporije isparava voda, to se dobijaju bolji kristali.

Slajd 4
Treća metoda je uzgoj kristala iz rastopljenih supstanci polaganim hlađenjem tekućine. Kada se koriste sve metode, najbolji rezultati se postižu ako se koristi sjeme - mali kristal pravilnog oblika, koji se stavlja u otopinu ili rastopi. Na taj način se, na primjer, dobijaju kristali rubina. Uzgoj kristala dragog kamenja odvija se vrlo sporo, ponekad godinama. Ako ubrzate kristalizaciju, tada ćete umjesto jednog kristala dobiti masu malih. Ova metoda se može izvesti samo u posebnim uređajima. Trenutno se više od polovine tehnički važnih kristala uzgaja iz taline. Jedna od najčešće korištenih industrijskih metoda za proizvodnju poluvodiča i drugih monokristala je metoda Czochralskog. Razvijen 1918. Početni materijal (punjenje) se ubacuje u vatrostalni lončić i zagrijava do rastaljenog stanja. Zatim se sjemenski kristal u obliku tanke šipke promjera nekoliko mm ugrađuje u ohlađeni kristalni držač i uranja u talinu

Slajd 5
Jan Czochralski (1885 - 1953) - Poljski hemičar, izumitelj danas nadaleko poznate metode uzgoja monokristala iz taline povlačenjem naviše sa slobodne površine, koja je kasnije nazvana po njemu. Prema nekim pričama, Čohralski je otkrio svoju čuvenu metodu 1916. godine, kada je slučajno ispustio pero u lonac od rastopljenog kalaja. Izvlačeći olovku iz lonca, otkrio je da se iza metalne olovke vukla tanka nit smrznutog lima. Zamijenivši pero olovke mikroskopskim komadom metala, Czochralski je bio uvjeren da tako formirana metalna nit ima monokristalnu strukturu. U eksperimentima koje je sproveo Czochralski, dobijeni su monokristali prečnika oko jedan milimetar i dužine do 150 cm.

Slajd 6
Defekti kristala U opisivanju strukture kristala do sada smo ih koristili idealni modeli. Razlika između pravih i idealnih kristala je u tome što pravi kristali nemaju pravilnu kristalnu rešetku. Oni uvijek sadrže kršenja stroge periodičnosti u rasporedu atoma. Ove nepravilnosti se nazivaju kristalni defekti. Defekti nastaju tokom rasta kristala pod uticajem toplotnog kretanja molekula, mehaničkih uticaja, zračenja tokovima čestica, usled prisustva nečistoća, itd. Defekti kristala su svako narušavanje translacione simetrije kristala - idealna periodičnost kristalne rešetke. Postoji nekoliko vrsta kvarova na osnovu veličine. Naime, postoje nuldimenzionalni (tačkasti), jednodimenzionalni (linearni), dvodimenzionalni (ravni) i trodimenzionalni (volumetrijski) defekti.

Slajd 7
Nuldimenzionalni (ili tačkasti) defekti u kristalu obuhvataju sve defekte koji su povezani sa pomeranjem ili zamenom male grupe atoma (intrinzični tačkasti defekti), kao i sa nečistoćama. Nastaju tokom zagrevanja, dopinga, tokom rasta kristala i kao rezultat izlaganja radijaciji. Mogu se uvesti i kao rezultat implantacije. Osobine takvih defekata i mehanizmi njihovog nastanka su najbolje proučeni, uključujući kretanje, interakciju, anihilaciju i isparavanje. Defekti, koji se nazivaju točkasti defekti, nastaju kada se jedan od atoma kristalne rešetke zamijeni atomom nečistoće (a), uvođenjem atoma između mjesta rešetke (b) ili kao rezultat formiranja slobodnih mjesta - odsutnosti atoma na jednom od mjesta rešetke (c).

Slajd 8
Supstitucione nečistoće, koje zamenjuju čestice glavne supstance na mestima rešetke, lakše se unose u rešetku što su atomski (jonski) radijusi nečistoće i glavne supstance bliži. Međuprostorne nečistoće zauzimaju međuprostore i, štaviše, što je lakše, to je veći volumen prostora između atoma. Uvedeni atomi ili ioni koji se razlikuju od glavnih atoma po veličini ili valenciji mogu biti ili unutrašnji ili nečisti atomi ili ioni. Ako je strani atom u čvoru, onda je to supstitucijski defekt; ako je u međuprostoru, onda je to međuprostorni atom. Položaji ravnoteže koje zauzimaju međuprostorni atomi zavise od materijala i tipa rešetke. Susedni atomi na mestima kristalne rešetke su blago pomereni, uzrokujući blagu deformaciju. Slobodna radna mjesta su najvažnija vrsta bodovnih nedostataka; ubrzavaju sve procese povezane s kretanjem atoma: difuziju, sinteriranje prahova itd. U tehnički čistim metalima, točkasti defekti povećavaju električni otpor, ali gotovo da nemaju utjecaja na mehanička svojstva. Samo kada visoke koncentracije defekti u ozračenim metalima, duktilnost se smanjuje i druga svojstva se primjetno mijenjaju.

Slajd 9
Kako se mogu pojaviti precizni nedostaci? Prema osnovnim principima statističke fizike, čak iu slučaju kada je prosječna kinetička energija atoma vrlo mala, uvijek će postojati određeni broj atoma veće energije, dovoljan da atom napusti mjesto kristalne rešetke. Krećući se oko kristala i dajući dio svoje energije drugim atomima, takav atom može biti smješten u međuprostorima. Kombinacija atoma u intersticijskom mjestu i slobodnog mjesta naziva se Frenkelov defekt (ili Frenkelov par). Vakans i međuprostorni atom povezani su značajnim elastičnim silama.
Frenkelovi defekti lako nastaju u kristalima koji sadrže značajne međuatomske šupljine. Primjeri takvih kristala su tvari sa strukturom dijamanta ili kamene soli.

Slajd 10
Defekti Šotkijeve tačke uglavnom se nalaze u čvrsto zbijenim kristalima, gde je formiranje međuprostornih atoma teško ili energetski nepovoljno. Neki atomi iz pripovršinskog sloja, kao rezultat termičkog kretanja, mogu napustiti kristal na površini (sl.). Prazno mjesto na ispražnjenom mjestu tada može migrirati u glavninu kristala. Formiranjem Schottkyjevih defekata smanjuje se gustoća kristala, budući da se njegov volumen povećava pri konstantnoj masi, dok nastajanjem Frenkelovih defekata gustoća ostaje nepromijenjena, jer se volumen cijelog tijela ne mijenja.
Walter Hermann Schottky (1886 - 1976) - poznati njemački fizičar, izumio je elektronsku cijev sa rešetkom 1915. i tetrodu 1919. godine. Godine 1938. Schottky je formulirao teoriju predviđanja Schottkyjevog efekta, koji se sada koristi u Schottky diodama.

Slajd 11
Dakle, predstavlja daleko od savršenog, urednog i u određenoj mjeri monotoni niz naizmjenično pozitivnih i negativnih jona, pravi kristali sadrže širok spektar zanimljivih točkastih defekata, koji, kao što ćemo vidjeti, mogu u velikoj mjeri utjecati na mnoga njihova svojstva. To su, kao što smo već rekli, intrinzični defekti čija koncentracija zavisi od temperature, i pored toga, ne-intrinzični, nečistoće koje su ili slučajno prisutne ili se namerno dodaju tokom rasta kristala. Svi ovi defekti se mogu smatrati kvazičesticama. Poput pravih čestica u vakuumu, one se mogu kretati i međusobno komunicirati na velikim udaljenostima kako bi formirale složenije strukture.

Slajd 12
Transportni procesi u kristalima Često se pogrešno veruje da su poznata alkalno-halogena jedinjenja kao što su natrijum hlorid i kalijum hlorid izolatori, ali su u stvari relativno dobri provodnici, posebno na povišenim temperaturama. Činjenica da provodljivost postoji, kao i činjenica da se i samodifuzija i difuzija iona nečistoća odvija prilično lako u jonskim čvrstim materijama, služe kao nepobitan dokaz o prisutnosti točkastih defekata u njima. Mnogi od ovih materijala nemaju elektronsku provodljivost - mjerenja pokazuju da je provodljivost posljedica migracije jona. Međutim, bez postojanja slobodnih mjesta ili međuprostornih atoma, kretanje iona u takvom klasičnom ionskom provodniku je nemoguće: to bi zahtijevalo previše energije. Zahvaljujući defektima i njihovom kretanju (sl.), proces kretanja jona se pretvara u razmjenu mjesta između jona i defekta; u ovom slučaju, količina potrebne energije se smanjuje.

Slajd 13
Difuzija (latinski diffusio - širenje, širenje, raspršivanje, interakcija) je proces međusobnog prodiranja molekula jedne tvari između molekula druge, što dovodi do spontanog izjednačavanja njihovih koncentracija u cijelom zauzetom volumenu. U nekim situacijama jedna od tvari već ima izjednačenu koncentraciju i govore o difuziji jedne tvari u drugu. U ovom slučaju, tvar se prenosi iz područja visoke koncentracije u područje niske koncentracije (duž gradijenta koncentracije). U kristalima mogu difundirati i vlastiti atomi rešetke (samodifuzija ili homodifuzija), i atomi drugih kemijskih elemenata otopljenih u tvari (nečistoća ili heterodifuzija), kao i točkasti defekti u kristalnoj strukturi - intersticijski atomi i prazna mjesta.

Slajd 14
Difuzija je proces na molekularnom nivou i određen je nasumičnom prirodom kretanja pojedinačnih molekula. Brzina difuzije je stoga proporcionalna prosječnoj brzini molekula. Ako je u mješavini plinova masa jednog molekula četiri puta veća od druge, tada se takav molekul kreće dvostruko sporije od kretanja u čistom plinu. Shodno tome, njegova brzina difuzije je također niža. Ova razlika u brzini difuzije lakih i teških molekula koristi se za razdvajanje supstanci različite molekulske težine. Primjer je razdvajanje izotopa. Ako se gas koji sadrži dva izotopa propušta kroz poroznu membranu, lakši izotopi prolaze kroz membranu brže od težih. Radi boljeg odvajanja, proces se provodi u nekoliko faza. Ovaj proces se naširoko koristi za odvajanje izotopa uranijuma (odvajanje 235U od mase 238U). (Trenutno se za razdvajanje izotopa uranijuma koristi metoda centrifugiranja, u kojoj se plin koji sadrži uranijum vrlo brzo rotira i zbog razlike u masi molekula izotopi se odvajaju, koji se zatim ponovo pretvaraju u metal. )

Slajd 15
Difuzija se fenomenološki pokorava Fickovim zakonima. Fick-ov 1. zakon utvrđuje proporcionalnost difuzijskog toka čestica prema njihovom koncentracijskom gradijentu; Fikov 2. zakon opisuje promjenu koncentracije zbog difuzije. Fenomen difuzije prvi je proučavao virzburški naučnik A. Fick na primjeru rastvora soli. Fick je pažljivim istraživanjem pokazao da se slobodna difuzija otopina soli odvija prema zakonima potpuno analognim zakonima širenja topline u čvrstim tvarima.

Slajd 16
Difuzija u kristalima Neke opće kristalografske karakteristike procesa difuzije su sasvim očigledne ako uzmemo u obzir geometriju kristala. Prije svega, difuzija se gotovo uvijek odvija postepeno, pri čemu je dužina elementarnih "koraka" reda jednog atomskog prečnika, odnosno nekoliko angstrema. Atomi se kreću skačući s jedne pozicije u rešetki na drugu. Ukupno, ovi elementarni skokovi osiguravaju kretanje atoma na velike udaljenosti. Hajde da saznamo koji je mehanizam pojedinačnih atomskih skokova. Postoji nekoliko mogućih shema: kretanje slobodnih mjesta, kretanje međuprostornih atoma ili neka metoda međusobne izmjene mjesta između atoma (sl.).
Atomska kretanja koja dovode do difuzije: a – kretanje slobodnih mjesta; b – kretanje međuprostornih atoma; c – razmjena mjesta dva atoma; d – razmjena prstena mjesta od četiri atoma

Slajd 17
Na osnovu ideje o točkastim defektima u kristalima, Frenkel je predložio dva glavna mehanizma difuzije u čvrstim tijelima: prazninu (slika a: atom se kreće, zamjenjujući mjesta s praznim mjestom) i intersticijalni (slika b: atom se kreće duž međuprostora). ). Druga metoda pomiče male (veličine) atome nečistoća, a prva metoda pomiče sve ostale: ovo je najčešći mehanizam difuzije.
Jakov Iljič Frenkel (1894 - 1952) - sovjetski naučnik, teorijski fizičar, jedan od osnivača fizike čvrstog stanja. Od 1921. do kraja života Frenkel je radio na Lenjingradskom institutu za fiziku i tehnologiju. Od 1922. Frenkel je objavljivao bukvalno svake godine nova knjiga. Postao je autor prvog kursa teorijske fizike u SSSR-u.

Slajd 18
Dislokacije Dislokacija je linearni defekt u kristalnoj rešetki čvrste supstance, koji predstavlja prisustvo „dodatne” atomske poluravnine. Najjednostavniji vizuelni model dislokacije ruba je knjiga u kojoj je dio otkinut s jedne od unutrašnjih stranica. Zatim, ako se stranice knjige uporede s atomskim ravnima, onda ivica pocijepanog dijela stranice modelira dislokacijske linije. Postoje vijčane i ivične dislokacije.

Slajd 19
Da bi se u idealnom kristalu stvorila dislokacija, potrebno je napraviti pomak u nekom dijelu ravni klizanja
Gustoća dislokacije varira u širokom rasponu i ovisi o stanju materijala. Nakon pažljivog žarenja, gustina dislokacija je niska; u kristalima sa jako deformiranom kristalnom rešetkom, gustina dislokacija dostiže vrlo visoke vrijednosti.

Slajd 20
Gustoća dislokacije u velikoj mjeri određuje plastičnost i čvrstoću materijala. Ako je gustoća manja od određene vrijednosti, tada se otpor na deformaciju naglo povećava, a čvrstoća se približava teorijskoj. Dakle, povećanje čvrstoće se postiže stvaranjem metala sa strukturom bez defekata, a s druge strane i povećanjem gustoće dislokacija, što otežava njihovo kretanje.

Slajd 21
Prilikom plastične deformacije jedan dio kristala se pomiče u odnosu na drugi pod utjecajem tangencijalnih naprezanja. Kada se opterećenje ukloni, smicanje ostaje, tj. dolazi do plastične deformacije. Primjena posmičnog naprezanja dovodi do pomicanja rubne dislokacije, a pomicanje njene ose za jednu translaciju znači promjenu poluravnine koja formira ovog trenutka dislokacija. Kretanje rubne dislokacije kroz cijeli kristal će dovesti do pomaka dijela kristala za jednu međuatomsku udaljenost. Rezultat toga je plastična deformacija kristala (sl.), tj. dijelovi kristala se pomjeraju jedan u odnosu na drugi za jednu translaciju.
Metal u napregnutom stanju uvijek doživljava normalna i tangencijalna naprezanja pod bilo kojom vrstom opterećenja. Povećanje normalnog i posmičnog naprezanja dovodi do različitih posljedica. Povećanje normalnog naprezanja dovodi do krtog loma. Plastična deformacija je uzrokovana tangencijalnim naprezanjima.

Slajd 22
Povećanje čvrstoće postiže se stvaranjem metala sa strukturom bez defekata, kao i povećanjem gustoće dislokacija, što otežava njihovo kretanje. Trenutno su stvoreni kristali bez defekata - brkovi dužine do 2 mm, debljine 0,5...20 mikrona - "brkovi" čvrstoće blizu teorijske. Dislokacije utiču ne samo na čvrstoću i duktilnost, već i na druga svojstva kristala. Kako se gustina dislokacija povećava, njihova optička svojstva, električni otpor metala se povećava. Dislokacije povećavaju prosječnu brzinu difuzije u kristalu, ubrzavaju starenje i druge procese, smanjuju kemijsku otpornost, pa se kao rezultat tretiranja površine kristala posebnim supstancama formiraju jame na mjestima gdje se pojavljuju dislokacije.

Slajd 23
Epitaksija je prirodni rast jednog kristalnog materijala na drugom (od grčkog επι - dalje i ταξισ - uređenje), tj. usmjereni rast jednog kristala na površini drugog (supstrata). Minimalna energija se troši ako kristal raste duž vijčane dislokacije.

Slajd 24
Hvala vam na pažnji!
Slajd 1
SVOJSTVA DEFEKATA I NJIHOVIH ANSAMBLA U KONDENZOVANOJ MATERI Radijaciona fizika čvrstih telaSlajd 2
 Sadržaj Odjeljak 1. Vrste pojedinačnih elementarnih nedostataka i njihova svojstva. Defekti u jednostavnim supstancama 1.1 Klasifikacija defekata u jednostavnim supstancama 1.1.1 Intersticijski 1.1.2 Slobodna mjesta u kovalentnim jedinjenjima 1.1.3. Karakteristike točkastih nedostataka 1.1.4. Internodije u jednostavnim tvarima i njihove karakteristike 1.1.5. Nedostaci pakovanja 1.1.6. Neuređene legure. Defekti nečistoće 1.1.7. Naručene legure. Vrste rešetki sa uređenjem 1.2 Ravnotežni i neravnotežni defekti 1.2.1 Ravnotežna koncentracija točkastih defekata u jednostavnim tvarima 1.3. Nedostaci u naručivanju legura 1.3.1 Metrika narudžbe dugog dometa u naručivanju legura 1.3.2 Metrika narudžbe kratkog dometa u naručivanju legura. Odnos dugog reda i prosječne vrijednosti kratkog reda u naručivanju legura 1.3.3 Temperaturna ovisnost koncentracije ravnotežnih supstitucijskih defekata u naručivanju legura 1.3.4. Temperaturna ovisnost koncentracije ravnotežnih slobodnih mjesta u naručivanju legura
Sadržaj Odjeljak 1. Vrste pojedinačnih elementarnih nedostataka i njihova svojstva. Defekti u jednostavnim supstancama 1.1 Klasifikacija defekata u jednostavnim supstancama 1.1.1 Intersticijski 1.1.2 Slobodna mjesta u kovalentnim jedinjenjima 1.1.3. Karakteristike točkastih nedostataka 1.1.4. Internodije u jednostavnim tvarima i njihove karakteristike 1.1.5. Nedostaci pakovanja 1.1.6. Neuređene legure. Defekti nečistoće 1.1.7. Naručene legure. Vrste rešetki sa uređenjem 1.2 Ravnotežni i neravnotežni defekti 1.2.1 Ravnotežna koncentracija točkastih defekata u jednostavnim tvarima 1.3. Nedostaci u naručivanju legura 1.3.1 Metrika narudžbe dugog dometa u naručivanju legura 1.3.2 Metrika narudžbe kratkog dometa u naručivanju legura. Odnos dugog reda i prosječne vrijednosti kratkog reda u naručivanju legura 1.3.3 Temperaturna ovisnost koncentracije ravnotežnih supstitucijskih defekata u naručivanju legura 1.3.4. Temperaturna ovisnost koncentracije ravnotežnih slobodnih mjesta u naručivanju legura
Slajd 3
 Sadržaj Odjeljak 2. Opis defekta u kristalnoj strukturi u okviru teorije elastičnosti 2.1. Osnovni principi mehanike kontinuuma 2.1.1. Definicije 2.1.2. Hookeov zakon 2.1.3. Hookeov zakon u generaliziranom obliku 2.1.4 Opći oblik jednadžbi u apsolutnim pomacima 2.2. Pomicanje atoma u kristalnoj rešetki sa tačkastim defektima. Promjena volumena 2.3. Ponašanje defekta u vanjskom polju pomaka 2.4. Gustina unutrašnjih sila ekvivalentna centru dilatacije 2.5. Interakcija defekata s vanjskim elastičnim poljem 2.6. Elastična interakcija tačkasti nedostaci 2.7. Kontinuirana distribucija tačkasti defekti u elastičnom polju 2.8. Crystal flow. Puzanje 2.9. Kinetika pora u kristalu 2.10. Nestabilnost ujednačene raspodjele točkastih defekata 2.11. Dislokacije 2.12. Plastična deformacija kristala 2.13. Jednodimenzionalni model dislokacije – Frenkel–Kontorova model
Sadržaj Odjeljak 2. Opis defekta u kristalnoj strukturi u okviru teorije elastičnosti 2.1. Osnovni principi mehanike kontinuuma 2.1.1. Definicije 2.1.2. Hookeov zakon 2.1.3. Hookeov zakon u generaliziranom obliku 2.1.4 Opći oblik jednadžbi u apsolutnim pomacima 2.2. Pomicanje atoma u kristalnoj rešetki sa tačkastim defektima. Promjena volumena 2.3. Ponašanje defekta u vanjskom polju pomaka 2.4. Gustina unutrašnjih sila ekvivalentna centru dilatacije 2.5. Interakcija defekata s vanjskim elastičnim poljem 2.6. Elastična interakcija tačkasti nedostaci 2.7. Kontinuirana distribucija tačkasti defekti u elastičnom polju 2.8. Crystal flow. Puzanje 2.9. Kinetika pora u kristalu 2.10. Nestabilnost ujednačene raspodjele točkastih defekata 2.11. Dislokacije 2.12. Plastična deformacija kristala 2.13. Jednodimenzionalni model dislokacije – Frenkel–Kontorova model
Slajd 4
 Sadržaj Odjeljak 3. Defekti zračenja 3.1. Metode STVARANJA RADIJACIJSKIH DEFEKATA 3.1.1. Zračenje u reaktoru 3.1.2. Zračenje na akceleratorima teških jona 3.1.3. Ozračenje u visokonaponskom elektronskom mikroskopu 3.1.4. Glavne prednosti i nedostaci metoda ispitivanja ekspresivnog zračenja 3.2. Primarni procesi interakcije čestica i zračenja sa čvrstim tijelom 3.2.1. Opšti pogledi o procesima interakcije čestica sa čvrstim tijelom 3.2.2. Interakcija neutrona sa materijom 3.2.3. Interakcija ubrzanih jona sa materijom 3.2.4. Distribucija prema dubini penetracije ugrađenih jona i defekti koje stvaraju joni 3.2.5. Interakcija elektrona sa materijom 3.2.6. Interakcija - kvanti sa materijom 3.3. Osnovni uslovi za ponovljivost pojava oštećenja reaktora pri zračenju akceleratora
Sadržaj Odjeljak 3. Defekti zračenja 3.1. Metode STVARANJA RADIJACIJSKIH DEFEKATA 3.1.1. Zračenje u reaktoru 3.1.2. Zračenje na akceleratorima teških jona 3.1.3. Ozračenje u visokonaponskom elektronskom mikroskopu 3.1.4. Glavne prednosti i nedostaci metoda ispitivanja ekspresivnog zračenja 3.2. Primarni procesi interakcije čestica i zračenja sa čvrstim tijelom 3.2.1. Opšti pogledi o procesima interakcije čestica sa čvrstim tijelom 3.2.2. Interakcija neutrona sa materijom 3.2.3. Interakcija ubrzanih jona sa materijom 3.2.4. Distribucija prema dubini penetracije ugrađenih jona i defekti koje stvaraju joni 3.2.5. Interakcija elektrona sa materijom 3.2.6. Interakcija - kvanti sa materijom 3.3. Osnovni uslovi za ponovljivost pojava oštećenja reaktora pri zračenju akceleratora
Slajd 5
 Sadržaj Odjeljak 4. Teorijsko poređenje strukture slučajnih polja radijacijskih defekata nastalih prilikom ozračivanja brzim česticama u uzorcima filma 4.1. Kaskada atomskih sudara. Individualne karakteristike 4.2. Slučajno polje defekata. Statistika štete 4.3. Model rijetkih kaskada 4.4. Model gustih kaskada 4.5. Parametri simulacije 4.6. Simulacijske relacije za modelne spektre PVA 4.7. Metodologija za određivanje privremenog vijeka supravodljivih spojeva 4.8. Proračun karakteristika polja oštećenja kada su tanki filmovi zračeni ionima i neutronima sa spektrom bliskim stvarnom TNR spektru
Sadržaj Odjeljak 4. Teorijsko poređenje strukture slučajnih polja radijacijskih defekata nastalih prilikom ozračivanja brzim česticama u uzorcima filma 4.1. Kaskada atomskih sudara. Individualne karakteristike 4.2. Slučajno polje defekata. Statistika štete 4.3. Model rijetkih kaskada 4.4. Model gustih kaskada 4.5. Parametri simulacije 4.6. Simulacijske relacije za modelne spektre PVA 4.7. Metodologija za određivanje privremenog vijeka supravodljivih spojeva 4.8. Proračun karakteristika polja oštećenja kada su tanki filmovi zračeni ionima i neutronima sa spektrom bliskim stvarnom TNR spektru
Slajd 6
 Uvod Studije "Fizika realnog čvrstog stanja". fizičke pojave i procesi uzrokovani ili proizašli iz visokog sadržaja defekata u čvrstoj tvari, pokušava razviti prediktivne teorije koje određuju karakteristike čvrste tvari. Sva područja primjene i “prisilne” upotrebe čvrstog tijela su, na ovaj ili onaj način, određena strukturalnim nedostacima. Najjednostavniji primjeri: vodljivost idealnog čvrstog tijela je nula; Kritična struja u supravodnicima je također jednaka nuli u odsustvu zapinjanja vorteks sistema na strukturnim defektima. Važan pravac je kontrolisano unošenje nečistoća i defekata u matricu, kao i radijacijom stimulisane promene u strukturi. Početak intenzivnog razvoja ovog pravca odgovara pojavi poluvodičkih uređaja. Ovaj pravac se može nazvati „fizičkom tehnologijom“ jer je dizajn i kreiranje novih instrumenata i alata za istraživače određen razvojem detaljne fizičke slike procesa i interpretacijom izmjerenih veličina. Prirodno smanjenje veličine objekata koji se proučavaju i nove mjerne mogućnosti dovele su do pojave novog smjera, “Nanosistemi”. Kontrolirano unošenje nečistoća i defekata u matricu je također od fizičkog interesa za analizu primjenjivosti određenih koncepata fizike kondenzirane materije. Na primjer, za analizu mehanizma supravodljivosti u spojevima sa A15, HTSC strukturom.
Uvod Studije "Fizika realnog čvrstog stanja". fizičke pojave i procesi uzrokovani ili proizašli iz visokog sadržaja defekata u čvrstoj tvari, pokušava razviti prediktivne teorije koje određuju karakteristike čvrste tvari. Sva područja primjene i “prisilne” upotrebe čvrstog tijela su, na ovaj ili onaj način, određena strukturalnim nedostacima. Najjednostavniji primjeri: vodljivost idealnog čvrstog tijela je nula; Kritična struja u supravodnicima je također jednaka nuli u odsustvu zapinjanja vorteks sistema na strukturnim defektima. Važan pravac je kontrolisano unošenje nečistoća i defekata u matricu, kao i radijacijom stimulisane promene u strukturi. Početak intenzivnog razvoja ovog pravca odgovara pojavi poluvodičkih uređaja. Ovaj pravac se može nazvati „fizičkom tehnologijom“ jer je dizajn i kreiranje novih instrumenata i alata za istraživače određen razvojem detaljne fizičke slike procesa i interpretacijom izmjerenih veličina. Prirodno smanjenje veličine objekata koji se proučavaju i nove mjerne mogućnosti dovele su do pojave novog smjera, “Nanosistemi”. Kontrolirano unošenje nečistoća i defekata u matricu je također od fizičkog interesa za analizu primjenjivosti određenih koncepata fizike kondenzirane materije. Na primjer, za analizu mehanizma supravodljivosti u spojevima sa A15, HTSC strukturom.
Slajd 7
 Brojni problematični problemi u fizici kondenzovanih sistema su fundamentalne prirode Predviđanje mehanička svojstva stvarne čvrste materije, uključujući one u intenzivnim poljima zračenja; Električna svojstva i pojave u kondenzovanim sistemima sa visokim sadržajem defekata; Mehanizmi supravodljivosti, uključujući visoke temperature, poboljšanje kritičnih parametara superprovodnika; Elektronska i fotonička svojstva organskih poluvodiča i kristala
Brojni problematični problemi u fizici kondenzovanih sistema su fundamentalne prirode Predviđanje mehanička svojstva stvarne čvrste materije, uključujući one u intenzivnim poljima zračenja; Električna svojstva i pojave u kondenzovanim sistemima sa visokim sadržajem defekata; Mehanizmi supravodljivosti, uključujući visoke temperature, poboljšanje kritičnih parametara superprovodnika; Elektronska i fotonička svojstva organskih poluvodiča i kristala
Slajd 8

Slajd 9
 Klasifikacija nedostataka jednostavnih supstanci. Definicija: Svaki poremećaj ili izobličenje pravilnosti rasporeda atoma u kristalu smatra se defektom u kristalnoj rešetki. Razlikuju se sljedeće vrste pojedinačnih defekata: Toplotno kretanje atoma Intersticijski atomi i praznine Atomi nečistoće Granica kristala Polikristali Dislokacije Statički pomaci rešetke u blizini defekta
Klasifikacija nedostataka jednostavnih supstanci. Definicija: Svaki poremećaj ili izobličenje pravilnosti rasporeda atoma u kristalu smatra se defektom u kristalnoj rešetki. Razlikuju se sljedeće vrste pojedinačnih defekata: Toplotno kretanje atoma Intersticijski atomi i praznine Atomi nečistoće Granica kristala Polikristali Dislokacije Statički pomaci rešetke u blizini defekta
Slajd 10
 1. Toplotno kretanje atoma, odstupanje atoma od ravnotežnog položaja; Ovo je termodinamički ravnotežni tip defekta koji ima dinamički karakter.
1. Toplotno kretanje atoma, odstupanje atoma od ravnotežnog položaja; Ovo je termodinamički ravnotežni tip defekta koji ima dinamički karakter.
Slajd 11
 2. Intersticijski atomi i slobodna mjesta. Ovi defekti imaju tendenciju da budu u ravnoteži. Karakteristično vrijeme relaksacije do ravnotežnog stanja može biti prilično dugo. Zaista, proces difuzije defekata, koji određuje njihovu distribuciju u čvrstom stanju, je termički aktiviran proces, pa se pri nedovoljno visokim temperaturama često javljaju neravnotežna stanja sistema ovih defekata. Značajna razlika između sistema točkastih defekata je prisustvo njihove međusobne interakcije (preko matričnih atoma), što dovodi, posebno, do stvaranja njihovih kompleksa (ansambala), kondenzata u matrici, tj. ravnotežno stanje sistema tačkastih defekata u većini slučajeva je nehomogeno u prostoru (na primjer, prazna mjesta - ansambl praznih mjesta - pora).
2. Intersticijski atomi i slobodna mjesta. Ovi defekti imaju tendenciju da budu u ravnoteži. Karakteristično vrijeme relaksacije do ravnotežnog stanja može biti prilično dugo. Zaista, proces difuzije defekata, koji određuje njihovu distribuciju u čvrstom stanju, je termički aktiviran proces, pa se pri nedovoljno visokim temperaturama često javljaju neravnotežna stanja sistema ovih defekata. Značajna razlika između sistema točkastih defekata je prisustvo njihove međusobne interakcije (preko matričnih atoma), što dovodi, posebno, do stvaranja njihovih kompleksa (ansambala), kondenzata u matrici, tj. ravnotežno stanje sistema tačkastih defekata u većini slučajeva je nehomogeno u prostoru (na primjer, prazna mjesta - ansambl praznih mjesta - pora).
Slajd 12
 3. Atomi nečistoća Nečistoće, čak i pri niskim koncentracijama, mogu značajno uticati na svojstva kristala, na primjer, daju značajan doprinos provodljivosti poluprovodnika.Gustoća atoma u kondenzovanim sistemima je 1022 - 1023 atoma/cm3, tj. koncentracija defekata, u zavisnosti od pozadine dobijanja uzorka, varira od 1012 - 1020 atom/cm3.
3. Atomi nečistoća Nečistoće, čak i pri niskim koncentracijama, mogu značajno uticati na svojstva kristala, na primjer, daju značajan doprinos provodljivosti poluprovodnika.Gustoća atoma u kondenzovanim sistemima je 1022 - 1023 atoma/cm3, tj. koncentracija defekata, u zavisnosti od pozadine dobijanja uzorka, varira od 1012 - 1020 atom/cm3.
Slajd 13
 4. Granica kristala Ovaj defekt dovodi do izobličenja čak i unutar matrice i do poremećaja kristalna simetrija u oblastima uz granicu. Uzorak zrna u polikristalu 5. Polikristalna zrna ili kristaliti različite orijentacije. Zapremina zrna je veća od fizički reprezentativne zapremine. Poprečna veličina zrna je oko 10-3 10-6 cm Osobine polikristala su određene kako samim kristalnim zrnima tako i granicama zrna. Ako su zrna mala i nasumično orijentirana, tada se u polikristalima ne pojavljuje anizotropija svojstava karakteristična, na primjer, za jedan kristal. Ako postoji određena orijentacija zrna, tada je polikristal teksturiran i ima anizotropiju.
4. Granica kristala Ovaj defekt dovodi do izobličenja čak i unutar matrice i do poremećaja kristalna simetrija u oblastima uz granicu. Uzorak zrna u polikristalu 5. Polikristalna zrna ili kristaliti različite orijentacije. Zapremina zrna je veća od fizički reprezentativne zapremine. Poprečna veličina zrna je oko 10-3 10-6 cm Osobine polikristala su određene kako samim kristalnim zrnima tako i granicama zrna. Ako su zrna mala i nasumično orijentirana, tada se u polikristalima ne pojavljuje anizotropija svojstava karakteristična, na primjer, za jedan kristal. Ako postoji određena orijentacija zrna, tada je polikristal teksturiran i ima anizotropiju.
Slajd 14
 Pojava rubne dislokacije na granici Vijčana dislokacija rasta kristala. Akumulacija dislokacija na granicama zrna Dislokacijska mreža Vijčana dislokacija 5. Dislokacije su neravnotežni tip defekta, tj. njihov izgled je određen praistorijom uzorka i povezan je ili s rastom kristalita ili s djelovanjem vanjskih opterećenja ili utjecaja. Postoji nekoliko vrsta dislokacija: rubne, vijčane, mješovite. Njihove akumulacije često formiraju granice zrna.
Pojava rubne dislokacije na granici Vijčana dislokacija rasta kristala. Akumulacija dislokacija na granicama zrna Dislokacijska mreža Vijčana dislokacija 5. Dislokacije su neravnotežni tip defekta, tj. njihov izgled je određen praistorijom uzorka i povezan je ili s rastom kristalita ili s djelovanjem vanjskih opterećenja ili utjecaja. Postoji nekoliko vrsta dislokacija: rubne, vijčane, mješovite. Njihove akumulacije često formiraju granice zrna.
Slajd 15
 U zavisnosti od dimenzija razlikuju se sledeće vrste defekata: 1. Tačkasti defekti: Intersticijski atomi i vakansi, Atomi nečistoća 2. Linearni defekti: Dislokacije 3. Planarni defekti: Granica kristala, Polikristali Fenomenološke karakteristike tačkastih defekata: - energija formiranja ; - energija migracije; - volumen dilatacije.
U zavisnosti od dimenzija razlikuju se sledeće vrste defekata: 1. Tačkasti defekti: Intersticijski atomi i vakansi, Atomi nečistoća 2. Linearni defekti: Dislokacije 3. Planarni defekti: Granica kristala, Polikristali Fenomenološke karakteristike tačkastih defekata: - energija formiranja ; - energija migracije; - volumen dilatacije.
Slajd 16
 U idealnoj strukturi nekog tipa, atom zauzima poziciju koja odgovara mjestu rešetke. Dodatni atom za koji ne postoji odgovarajuće mjesto zauzima međuprostornu poziciju. Može postojati nekoliko takvih odredbi za strukturu. Različiti tipovi intersticijskih atoma ugljika u dijamantskoj rešetki: a – Tetraedarski – T; b – Heksagonalni –H; c – internod u sredini veze – M; d – Split internodije (bučica -). internodije
U idealnoj strukturi nekog tipa, atom zauzima poziciju koja odgovara mjestu rešetke. Dodatni atom za koji ne postoji odgovarajuće mjesto zauzima međuprostornu poziciju. Može postojati nekoliko takvih odredbi za strukturu. Različiti tipovi intersticijskih atoma ugljika u dijamantskoj rešetki: a – Tetraedarski – T; b – Heksagonalni –H; c – internod u sredini veze – M; d – Split internodije (bučica -). internodije
Slajd 17
 Dodatni atom, za koji ne postoji odgovarajuće mjesto, zauzima međuprostornu poziciju i remeti distribuciju elektronske gustine unutar jedinične ćelije Vlastito međuprostorno mjesto u dijamantu Distribucija gustine elektrona u jediničnoj ćeliji dijamanta i u ćeliji koja sadrži tetraedarski intersticijski atom ugljika. Nivo prikazanih izopovršina je isti =1,25
Dodatni atom, za koji ne postoji odgovarajuće mjesto, zauzima međuprostornu poziciju i remeti distribuciju elektronske gustine unutar jedinične ćelije Vlastito međuprostorno mjesto u dijamantu Distribucija gustine elektrona u jediničnoj ćeliji dijamanta i u ćeliji koja sadrži tetraedarski intersticijski atom ugljika. Nivo prikazanih izopovršina je isti =1,25
Slajd 18
 Slobodna mjesta u kovalentnim jedinjenjima Odsustvo atoma na mjestu rešetke stvara točkasti defekt kao što je praznina: Konfiguracija praznine i divakansije u dijamantu. Obrazac pomaka se razlikuje od pomaka za međuprostorne atome u smjeru; obično je najbliže okruženje pomaknuto prema praznoj lokaciji. U vezama jonski tip slobodna mjesta se formiraju u parovima, što je energetski povoljnija konfiguracija za datu strukturu (Schottkyjev defekt). Oslikava se potreba za održavanjem neutralnosti. Ova vrsta defekata se manifestuje povoljnije što je veća ionnost veze, na primjer u NaCl. Imajte na umu da je u HTSC tipa YBa2Cu3O7 veza djelomično jonska.
Slobodna mjesta u kovalentnim jedinjenjima Odsustvo atoma na mjestu rešetke stvara točkasti defekt kao što je praznina: Konfiguracija praznine i divakansije u dijamantu. Obrazac pomaka se razlikuje od pomaka za međuprostorne atome u smjeru; obično je najbliže okruženje pomaknuto prema praznoj lokaciji. U vezama jonski tip slobodna mjesta se formiraju u parovima, što je energetski povoljnija konfiguracija za datu strukturu (Schottkyjev defekt). Oslikava se potreba za održavanjem neutralnosti. Ova vrsta defekata se manifestuje povoljnije što je veća ionnost veze, na primjer u NaCl. Imajte na umu da je u HTSC tipa YBa2Cu3O7 veza djelomično jonska.
Slajd 19
 Nema atoma na odgovarajućem mjestu, što dovodi do poremećaja u raspodjeli elektronske gustine unutar jedinične ćelije Pojedinačno slobodno mjesto u dijamantu Distribucija elektronske gustine u idealnoj jediničnoj ćeliji dijamanta i u ćeliji koja sadrži jedno slobodno mjesto. Nivo prikazanih izopovršina je isti =1,25
Nema atoma na odgovarajućem mjestu, što dovodi do poremećaja u raspodjeli elektronske gustine unutar jedinične ćelije Pojedinačno slobodno mjesto u dijamantu Distribucija elektronske gustine u idealnoj jediničnoj ćeliji dijamanta i u ćeliji koja sadrži jedno slobodno mjesto. Nivo prikazanih izopovršina je isti =1,25
Slajd 20

Slajd 21
 Model za formiranje praznine u jednostavnim supstancama Može se predložiti sljedeći mehanizam za formiranje praznine. Atom je doveden do granice kristala, dok se broj čestica u sistemu ne mijenja. Zaista, jednostavno uklanjanje atoma sa mjesta kristalne rešetke do beskonačnosti mijenja broj čestica u sistemu, a za izračunavanje termodinamičkog potencijala sistema bit će potrebno uzeti u obzir ovu činjenicu. U blizini formiranog slobodnog mjesta doći će do relaksacije atoma (crvene strelice na slici). Pretpostavit ćemo da dva atoma tvari međusobno djeluju kroz potencijal parne interakcije, koji ne ovisi o okruženju atoma.
Model za formiranje praznine u jednostavnim supstancama Može se predložiti sljedeći mehanizam za formiranje praznine. Atom je doveden do granice kristala, dok se broj čestica u sistemu ne mijenja. Zaista, jednostavno uklanjanje atoma sa mjesta kristalne rešetke do beskonačnosti mijenja broj čestica u sistemu, a za izračunavanje termodinamičkog potencijala sistema bit će potrebno uzeti u obzir ovu činjenicu. U blizini formiranog slobodnog mjesta doći će do relaksacije atoma (crvene strelice na slici). Pretpostavit ćemo da dva atoma tvari međusobno djeluju kroz potencijal parne interakcije, koji ne ovisi o okruženju atoma.
Slajd 22
 Energija atoma koji se nalazi na mjestu kristala jednaka je Esite=z1*φ(R*), gdje je broj najbližih susjeda reda z1 6 - 8, R* je ravnotežna međuatomska udaljenost, procjena potencijal φ(R*) se može napraviti, na primjer, iz energije sublimacije supstance, što daje φ(R*) ≈ 0,2 ÷ 0,3eV. Dakle, energetska vrijednost atoma na mjestu rešetke je Esite ~ 1,6 ÷ 2,4 eV. Takva energija mora biti utrošena da bi se prekinule veze tokom formiranja slobodnog mjesta. Međutim, uklonjeni atom je postavljen na površinu, stoga možemo pretpostaviti da je polovina prekinutih veza obnovljena. Energija atoma koji se nalazi na površini je jednaka. Dakle, energija formiranja praznine Ef ≈ 0,8 ÷ 1,2 eV. Migracija slobodnih radnih mjesta Razmotrimo migraciju slobodnih radnih mjesta. Da bi atom A skočio na prazno mjesto na kojem se nalazi slobodno mjesto, činilo bi se da ne mora prevladati barijeru, ali to nije slučaj - veze moraju biti prekinute. Proračun energije formiranja slobodnih mjesta
Energija atoma koji se nalazi na mjestu kristala jednaka je Esite=z1*φ(R*), gdje je broj najbližih susjeda reda z1 6 - 8, R* je ravnotežna međuatomska udaljenost, procjena potencijal φ(R*) se može napraviti, na primjer, iz energije sublimacije supstance, što daje φ(R*) ≈ 0,2 ÷ 0,3eV. Dakle, energetska vrijednost atoma na mjestu rešetke je Esite ~ 1,6 ÷ 2,4 eV. Takva energija mora biti utrošena da bi se prekinule veze tokom formiranja slobodnog mjesta. Međutim, uklonjeni atom je postavljen na površinu, stoga možemo pretpostaviti da je polovina prekinutih veza obnovljena. Energija atoma koji se nalazi na površini je jednaka. Dakle, energija formiranja praznine Ef ≈ 0,8 ÷ 1,2 eV. Migracija slobodnih radnih mjesta Razmotrimo migraciju slobodnih radnih mjesta. Da bi atom A skočio na prazno mjesto na kojem se nalazi slobodno mjesto, činilo bi se da ne mora prevladati barijeru, ali to nije slučaj - veze moraju biti prekinute. Proračun energije formiranja slobodnih mjesta
Slajd 23
 Osim toga, duž putanje migracije praznine (ili atoma A), pojavljuje se energetska barijera (energetska leća) koju stvaraju obližnji atomi. Ovo je najjasnije vidljivo u trodimenzionalnom kristalu.Broj najbližih susjeda u ABCD presjeku je obično manji nego na mjestu, z2 = 4. Ako pretpostavimo da se potencijal para slabo mijenja, tada je energetska barijera za migraciju slobodnih mjesta može se procijeniti kao Emγ ≈ 0,8 ÷ 1 eV.
Osim toga, duž putanje migracije praznine (ili atoma A), pojavljuje se energetska barijera (energetska leća) koju stvaraju obližnji atomi. Ovo je najjasnije vidljivo u trodimenzionalnom kristalu.Broj najbližih susjeda u ABCD presjeku je obično manji nego na mjestu, z2 = 4. Ako pretpostavimo da se potencijal para slabo mijenja, tada je energetska barijera za migraciju slobodnih mjesta može se procijeniti kao Emγ ≈ 0,8 ÷ 1 eV.
Slajd 24
 Dilatacijski volumen slobodnog prostora Neka je ω0 zapremina po jednom atomu čvrste tvari. Kada se formira praznina, površina će biti izobličena zbog opuštanja, a volumen kristala V će se promijeniti. Procjene daju približno δV(1)= - 0,1ω0, ovaj rezultat je dobiven na osnovu rezultata dilatacijskih eksperimenata povezanih s unošenjem velikog broja slobodnih mjesta u uzorak. Imajte na umu da u matrici koja okružuje područje formiranja praznine dolazi do blagog povećanja gustine supstance zbog relaksacije. U mehanizmu formiranja praznine o kojem smo gore govorili, atom izlazi na površinu. Povezana dodatna promjena volumena je δV(2)=+ω0. Dakle, ukupna promjena volumena kristala jednaka je: δV=δV(1) + δV(2) =+0,9ω0 Promjena zapremine
Dilatacijski volumen slobodnog prostora Neka je ω0 zapremina po jednom atomu čvrste tvari. Kada se formira praznina, površina će biti izobličena zbog opuštanja, a volumen kristala V će se promijeniti. Procjene daju približno δV(1)= - 0,1ω0, ovaj rezultat je dobiven na osnovu rezultata dilatacijskih eksperimenata povezanih s unošenjem velikog broja slobodnih mjesta u uzorak. Imajte na umu da u matrici koja okružuje područje formiranja praznine dolazi do blagog povećanja gustine supstance zbog relaksacije. U mehanizmu formiranja praznine o kojem smo gore govorili, atom izlazi na površinu. Povezana dodatna promjena volumena je δV(2)=+ω0. Dakle, ukupna promjena volumena kristala jednaka je: δV=δV(1) + δV(2) =+0,9ω0 Promjena zapremine