Biološki značaj kiseonika. Biološka uloga. Biti u prirodi
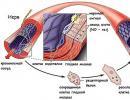
Kiseonik je deo svih vitalnih organskih supstanci - proteina, masti, ugljenih hidrata. Bez kisika su nemogući procesi disanja, oksidacije aminokiselina, masti i ugljikohidrata. Kod viših životinja kisik ulazi u krv, spajajući se s hemoglobinom i formira oksihemoglobin. Oksihemoglobin HbO 2 u kapilarama odaje kiseonik HbO 2 ® Hb + O 2 kroz zidove kapilara. O 2 (kiseonik) ulazi u ćelije, gde se troši na oksidaciju različitih supstanci, kao rezultat ovih procesa nastaju CO 2 i H 2 O, oslobađa se energija:
Hb + CO 2 ® HbCO 2 (karboksihemoglobin)
Alotropska modifikacija kiseonika, ozona – O 3, igra određenu ulogu u stvaranju radikala. Ovi radikali pokreću radikalne lančane reakcije sa bioorganskim molekulima – lipidima, proteinima, DNK, što dovodi do smrti ćelije. Ovo je osnova za djelovanje ozona na mikroorganizme sadržane u zraku i vodi. Zbog toga se O 3 koristi za ozoniranje zraka, dezinfekciju vode za piće i bazenske vode. U atmosferi sa viškom ozona (njegov izvor su izduvni gasovi), u ljudskom organizmu nastaju radikali (RO 2 ·; OH ·) koji mogu izazvati tumorske bolesti. Osim toga, ozon igra važnu ulogu u zaštiti bioloških objekata Zemlje od tvrdog rendgenskog zračenja, jer Na visini od ~25 km formira se ozonski omotač koji apsorbuje zrake sa l £ 260 nm.
Od jedinjenja kiseonika veoma su važni H 2 O 2 i H 2 O. Ljudsko telo sadrži oko 80% vode. Zbog svoje strukture (dvije sp 3 hibridne orbitale su povezane, dvije sadrže usamljeni par elektrona), voda ima vrlo visok dipolni moment i stoga je univerzalni rastvarač. U ljudskom i životinjskom tijelu rastvara organske i neorganske tvari i pospješuje njihovu ionizaciju (disocijaciju). Voda je i medij u kojem se odvijaju biohemijske reakcije i učesnik u reakcijama hidrolize masti, ATP-a, ADP-a itd.
Biološka uloga vodikovog peroksida
U mitohondrijama, H atomi odcijepljeni od supstrata u obliku H+ pod djelovanjem dehidroginaze se vezuju za kisik, formirajući vodu.
4H + + O 2 + 4e - ® 2H 2 O
U ovom slučaju važno je dodati tačno 4 elektrona, jer kada se dodaju 2 elektrona, nastaje vodikov peroksid
2H + + O 2 + 2e - ® H 2 O 2
Kada se doda jedan elektron, formira se hiperoksidni ion
O 2 · + e - ® O 2 -
Vodikov peroksid i hiperoksidni radikal O 2 su toksični za stanice jer oni stupaju u interakciju s lipidima staničnih membrana i onesposobljavaju ih, remete strukturu stanice, uključujući DNK i njenu reparativnu funkciju. Aerobne ćelije, koristeći enzim katalaze i superoksid dismutazu (enzim koji sadrži bakar), pretvaraju H 2 O 2 i O 2 - u O 2
2O 2 - + 2H + 2O - + 2H + H 2 O 2 + O 2
2H 2 O 2 2H 2 O + O 2
Primjena u medicini. Lijekovi
Oxygenium(O 2) – kiseonik. Unosi se u organizam inhalacijom u slučaju kardiovaskularne insuficijencije, ublažava gladovanje kiseonikom (hipoksiju). Unosi se u gastrointestinalni trakt putem sonde za helmintozu (okrugle gliste, bičeve).
Aqua purificata(H 2 O) – prečišćena voda. Koristi se za pripremu tečnih doznih oblika.
Solutiohydrogenii peroxididiluta(3%) – rastvor vodonik peroksida (3%).
perhidrol (33-35%) perhidrol. rastvor vodonik peroksida 33-35% .
Magnesii peroksidum,(MgO 2 ´MgO) – magnezijum peroksid.
Hidroperitum(H 2 O 2 ´NH 2 -CO-NH 2) – hidroperit (sadrži 0,08% limunske kiseline).
Preparati vodikovog peroksida se koriste spolja za liječenje rana, ispiranje usta i grla kao antiseptik i dezodorans.
Sumpor
Sumpor je element glavne podgrupe grupe VI periodnog sistema
DI. Mendeljejev. U ovoj grupi, počevši od sumpora (3. period), pojavljuje se d-podnivo, pa se broj nesparenih elektrona može povećati sa 2 na 4 i 6, zbog uparivanja s- i p-elektrona i njihovog pomeranja na d -podnivo:
Dakle, moguća i ispoljena oksidaciona stanja sumpora su: -2, +2, +4 i +6.
Od vrha do dna u podgrupi od kiseonika do polonijuma, veličine atoma se povećavaju, a energija jonizacije opada, a nemetalna svojstva u nizu: O – S – Se – Te – Po slabe.
Sumpor je tipičan nemetal; po svojoj OEO vrijednosti (2,5) je drugi nakon halogena, kisika i dušika.
Sumpor je jedan od uobičajenih elemenata. U zemljinoj kori njegov sadržaj je 0,05 tež. %, u morskoj vodi 0,08 - 0,09%. Sastoji se od četiri stabilna izotopa: 32 S (95,084%), 33 S (0,74%), 34 S (4,16%) i 36 S (0,016%). Dobijeni su radioaktivni izotopi sumpora: 31 S (T 1/2 = 2,66 sek.), 35 S (T 1/2 = 86,3 dana) i 37 S (T 1/2 = 5,07 min.).
Sumpor se u prirodi javlja u prirodnom stanju (uglavnom u blizini vulkana i u toplim mineralnim izvorima, kao produkt oksidacije sumporovodika).
Koristio se za pripremu boja, kao medicinski proizvod, ali i u druge svrhe.
Sumpor se nalazi u raznim stijenama: krečnjaku, kalcitu, gipsu itd.; u sumpornim rudama i mineralima, u živim i biljnim organizmima (0,16% u ljudskom tijelu je makroelement), tj. u mnogim neorganskim i organskim jedinjenjima. Glavni minerali sumpora:
Kiseonik je organogeni element. Njegov sadržaj čini do 65% tjelesne težine osobe, odnosno više od 40 kg za odraslu osobu. Kiseonik je najčešći oksidant na Zemlji; u okolini je predstavljen u dva oblika - u obliku jedinjenja (zemljina kora i voda: oksidi, peroksidi, hidroksidi itd.) i u slobodnom obliku (atmosfera).
Biološka uloga kiseonika
Glavna (zapravo, jedina) funkcija kisika je njegovo sudjelovanje kao oksidacijskog agensa u redoks reakcijama u tijelu. Zahvaljujući prisustvu kiseonika, organizmi svih životinja su u stanju da iskoriste (zapravo „sagore“) razne supstance ( ugljikohidrati, masti, vjeverice) sa vađenjem određene energije „sagorevanja“ za sopstvene potrebe. U mirovanju tijelo odrasle osobe troši 1,8-2,4 g kisika u minuti.
Izvori kiseonika
Glavni izvor kiseonika za ljude je Zemljina atmosfera, odakle ljudsko telo disanjem može da izvuče potrebnu količinu kiseonika za život.
Nedostatak kiseonika
Kada u ljudskom organizmu postoji nedostatak, nastaje takozvana hipoksija.
Uzroci nedostatka kiseonika
- odsutnost ili naglo smanjen sadržaj kisika u atmosferi;
- smanjen parcijalni pritisak kiseonika u udahnutom vazduhu (pri izlasku na velike visine - u planinama, u avionu);
- prestanak ili smanjenje opskrbe pluća kisikom tokom asfiksije;
- poremećaji transporta kiseonika (poremećaji kardiovaskularnog sistema; značajno smanjenje hemoglobina u krvi tokom anemije, nemogućnost hemoglobina da obavlja svoje funkcije - da veže, transportuje ili oslobađa kiseonik u tkiva, na primer, u slučaju trovanja ugljen-monoksidom );
- nemogućnost tkiva da iskoriste kisik zbog poremećaja redoks procesa u tkivima (na primjer, trovanje cijanidom)
Posljedice nedostatka kisika
Kod akutne hipoksije:
- gubitak svijesti;
- poremećaj, nepovratna oštećenja i brza smrt centralnog nervnog sistema (bukvalno za nekoliko minuta)
- Za hroničnu hipoksiju:
- brz fizički i mentalni zamor;
- poremećaji centralnog nervnog sistema;
- tahikardija i kratak dah u mirovanju ili uz malu fizičku aktivnost
Višak kiseonika
Uočava se izuzetno rijetko, u pravilu, u umjetnim uvjetima (na primjer, hiperbarične komore, pogrešno odabrane smjese za disanje prilikom ronjenja u vodi itd.). U ovom slučaju, produženo udisanje zraka prekomjerno obogaćenog kisikom praćeno je trovanjem kisikom - kao rezultat njegove prekomjerne količine nastaje veliki broj slobodnih radikala u organima i tkivima, te proces spontane oksidacije organskih tvari, uključujući započinje lipidna peroksidacija.
Dnevne potrebe: nije standardizovano
Plan:
Istorija otkrića
Porijeklo imena
Biti u prirodi
Potvrda
Fizička svojstva
Hemijska svojstva
Aplikacija
Biološka uloga kiseonika
Toksični derivati kiseonika
10. Izotopi
Kiseonik
Kiseonik- element 16. grupe (prema zastarjeloj klasifikaciji - glavna podgrupa grupe VI), drugi period periodnog sistema hemijskih elemenata D.I. Mendeljejeva, sa atomskim brojem 8. Označen simbolom O (lat. Oxygenium) . Kiseonik je hemijski aktivan nemetal i najlakši je element iz grupe halkogena. Jednostavna supstanca kiseonik(CAS broj: 7782-44-7) u normalnim uslovima je gas bez boje, ukusa i mirisa, čija se molekula sastoji od dva atoma kiseonika (formula O 2), pa se zbog toga naziva i dioksigen.Tečni kiseonik ima svetlost plave boje, a čvrsti kristali su svijetloplave boje.
Postoje i drugi alotropni oblici kiseonika, na primer, ozon (CAS broj: 10028-15-6) - u normalnim uslovima, plavi gas specifičnog mirisa, čiji se molekul sastoji od tri atoma kiseonika (formula O 3).
Istorija otkrića
Službeno se vjeruje da je kisik otkrio engleski hemičar Joseph Priestley 1. avgusta 1774. razlaganjem živinog oksida u hermetički zatvorenoj posudi (Priestley je usmjerio sunčevu svjetlost na ovo jedinjenje koristeći moćno sočivo).
Međutim, Priestley u početku nije shvatio da je otkrio novu jednostavnu supstancu; vjerovao je da je izolirao jedan od sastavnih dijelova zraka (i nazvao je ovaj plin "deflogisticirani zrak"). Priestley je svoje otkriće prijavio izvanrednom francuskom hemičaru Antoineu Lavoisieru. A. Lavoisier je 1775. ustanovio da je kiseonik sastavni deo vazduha, kiselina i da se nalazi u mnogim supstancama.
Nekoliko godina ranije (1771.), kiseonik je nabavio švedski hemičar Karl Scheele. Kalcinirao je salitru sumpornom kiselinom, a zatim razgradio nastali dušikov oksid. Scheele je ovaj plin nazvao "vatrenim zrakom" i opisao svoje otkriće u knjizi objavljenoj 1777. (upravo zato što je knjiga objavljena kasnije nego što je Priestley najavio svoje otkriće, ovaj drugi se smatra otkrićem kisika). Šele je takođe prijavio svoje iskustvo Lavoisieru.
Važan korak koji je pridonio otkriću kisika bio je rad francuskog hemičara Pierrea Bayena, koji je objavio radove o oksidaciji žive i kasnijoj razgradnji njenog oksida.
Konačno, A. Lavoisier je konačno shvatio prirodu nastalog plina, koristeći informacije Priestleya i Scheelea. Njegov rad je bio od ogromnog značaja jer je zahvaljujući njemu srušena teorija flogistona, koja je u to vrijeme bila dominantna i kočila razvoj hemije. Lavoisier je provodio eksperimente sa izgaranjem raznih tvari i opovrgao teoriju flogistona, objavljujući rezultate o težini spaljenih elemenata. Težina pepela je premašila prvobitnu težinu elementa, što je Lavoisieru dalo pravo da tvrdi da se tokom sagorevanja dešava hemijska reakcija (oksidacija) supstance, pa se stoga masa izvorne supstance povećava, što pobija teoriju flogistona. .
Dakle, zasluge za otkriće kiseonika zapravo dijele Priestley, Scheele i Lavoisier.
porijeklo imena
Reč kiseonik (početkom 19. veka nazivana i „kiselinski rastvor“) donekle duguje svoju pojavu u ruskom jeziku M. V. Lomonosovu, koji je uveo reč „kiselina“, zajedno sa drugim neologizmima; Dakle, riječ "kiseonik", zauzvrat, bila je trag izraza "kiseonik" (francuski oxygène), koji je predložio A. Lavoisier (od starogrčkog ὀξύς - "kiseo" i γεννάω - "rađanje"), što je prevedeno kao “generirajuća kiselina”, što je povezano s njegovim izvornim značenjem – “kiselina”, što je ranije značilo tvari zvane oksidi prema modernoj međunarodnoj nomenklaturi.
Biti u prirodi
Kiseonik je najčešći element na Zemlji; njegov udio (u raznim jedinjenjima, uglavnom silikatima) čini oko 47,4% mase čvrste zemljine kore. Morske i slatke vode sadrže ogromnu količinu vezanog kiseonika - 88,8% (masenih), u atmosferi je sadržaj slobodnog kiseonika 20,95% po zapremini i 23,12% po masi. Više od 1.500 jedinjenja u zemljinoj kori sadrži kiseonik.
Kiseonik je dio mnogih organskih tvari i prisutan je u svim živim stanicama. Što se tiče broja atoma u živim ćelijama, on je oko 25%, a po masenom udjelu - oko 65%.
Otkriće kiseonika dogodilo se dva puta, u drugoj polovini 18. veka, u razmaku od nekoliko godina. Godine 1771. kisik je dobio Šveđanin Karl Scheele zagrijavanjem salitre i sumporne kiseline. Nastali plin je nazvan "vatreni zrak". Godine 1774. engleski hemičar Joseph Priestley izveo je proces razgradnje živinog oksida u potpuno zatvorenoj posudi i otkrio kisik, ali ga je zamijenio sa sastojkom u zraku. Tek nakon što je Priestley podijelio svoje otkriće sa Francuzom Antoineom Lavoisierom, postalo je jasno da je otkriven novi element (kalorizator). Priestley preuzima vodstvo u ovom otkriću jer je Scheele objavio svoj naučni rad koji opisuje otkriće tek 1777. godine.
Kiseonik je element grupe XVI perioda II periodnog sistema hemijskih elemenata D.I. Mendeljejev, ima atomski broj 8 i atomsku masu 15,9994. Uobičajeno je da se kiseonik označava simbolom O(iz latinskog Oxygenium- stvaranje kiseline). Na ruskom naziv kiseonik postao derivat od kiseline, termin koji je uveo M.V. Lomonosov.
Biti u prirodi
Kiseonik je najčešći element koji se nalazi u zemljinoj kori i Svjetskom okeanu. Jedinjenja kiseonika (uglavnom silikati) čine najmanje 47% mase zemljine kore; kiseonik se proizvodi tokom fotosinteze u šumama i svim zelenim biljkama, od kojih većina dolazi iz fitoplanktona u morskim i slatkim vodama. Kiseonik je esencijalna komponenta bilo koje žive ćelije, a nalazi se i u većini supstanci organskog porekla.
Fizička i hemijska svojstva
Kiseonik je lagan nemetal, pripada grupi halkogena i ima visoku hemijsku aktivnost. Kiseonik je, kao jednostavna supstanca, gas bez boje, mirisa i ukusa, u tečnom je stanju - svetloplava prozirna tečnost i čvrstom stanju - svetloplavi kristali. Sastoji se od dva atoma kiseonika (označeno formulom O₂).
Kiseonik je uključen u redoks reakcije. Živa bića udišu kiseonik iz vazduha. Kiseonik se široko koristi u medicini. U slučaju kardiovaskularnih bolesti, radi poboljšanja metaboličkih procesa, u želudac se ubrizgava kisikova pjena („kiseonički koktel“). Subkutana primjena kisika koristi se za trofične čireve, elefantijazu i gangrenu. Umjetno obogaćivanje ozona koristi se za dezinfekciju i dezodoraciju zraka i prečišćavanje vode za piće.

Kiseonik je osnova životne aktivnosti svih živih organizama na Zemlji i glavni je biogeni element. Nalazi se u molekulima svih najvažnijih supstanci koje su odgovorne za građu i funkcije stanica (lipida, proteina, ugljikohidrata, nukleinskih kiselina). Svaki živi organizam sadrži mnogo više kisika od bilo kojeg elementa (do 70%). Na primjer, tijelo prosječnog odraslog čovjeka težine 70 kg sadrži 43 kg kisika.
Kiseonik ulazi u žive organizme (biljke, životinje i ljude) kroz respiratorni sistem i unosom vode. Sjećajući se da je u ljudskom tijelu najvažniji respiratorni organ koža, postaje jasno koliko kisika čovjek može primiti, posebno ljeti na obali rezervoara. Odrediti potrebu osobe za kiseonikom je prilično teško, jer zavisi od mnogih faktora - starosti, pola, telesne težine i površine, sistema ishrane, spoljašnje sredine itd.

Upotreba kiseonika u životu
Kiseonik se koristi skoro svuda - od metalurgije do proizvodnje raketnog goriva i eksploziva koji se koriste za radove na putevima u planinama; od medicine do prehrambene industrije.
U prehrambenoj industriji kiseonik je registrovan kao aditiv za hranu, kao pogonsko gorivo i gas za pakovanje.
Kiseonik je najzastupljeniji element na Zemlji. Morska voda sadrži 85,82% kiseonika, atmosferski vazduh 23,15% po težini ili 20,93% po zapremini, a zemljina kora sadrži 47,2% mase. Ova koncentracija kisika u atmosferi se održava konstantnom procesom fotosinteze. U ovom procesu, zelene biljke pretvaraju ugljični dioksid i vodu u ugljikohidrate i kisik kada su izložene sunčevoj svjetlosti. Najveći dio kiseonika je u vezanom stanju; Količina molekularnog kiseonika u atmosferi iznosi samo 0,01% ukupnog sadržaja kiseonika u zemljinoj kori. U prirodnom životu kiseonik je od izuzetnog značaja. Kiseonik i njegovi spojevi su neophodni za održavanje života. Oni igraju vitalnu ulogu u metaboličkim procesima i disanju. Kiseonik je deo proteina, masti, ugljenih hidrata, od kojih su organizmi „izgrađeni“; Ljudsko tijelo, na primjer, sadrži oko 65% kiseonika. Većina organizama energiju potrebnu za obavljanje vitalnih funkcija dobiva oksidacijom određenih tvari uz pomoć kisika. Gubitak kiseonika u atmosferi kao rezultat procesa disanja, raspadanja i sagorevanja nadoknađuje se kiseonikom koji se oslobađa tokom fotosinteze. Krčenje šuma, erozija tla i razne površinske eksploatacije smanjuju ukupnu masu fotosinteze i smanjuju ciklus na velikim površinama.
Kiseonik nije uvek bio deo Zemljine atmosfere. Pojavio se kao rezultat vitalne aktivnosti fotosintetskih organizama. Pod uticajem ultraljubičastih zraka pretvorio se u ozon. Kako se ozon akumulirao, u gornjim slojevima atmosfere formirao se ozonski omotač. Ozonski omotač, poput ekrana, pouzdano štiti površinu Zemlje od ultraljubičastog zračenja koje je pogubno za žive organizme.
Geohemijski ciklus kiseonika povezuje plinovite i tečne ljuske sa zemljinom korom. Njegove glavne točke: oslobađanje slobodnog kisika tijekom fotosinteze, oksidacija kemijskih elemenata, ulazak ekstremno oksidiranih spojeva u duboke zone zemljine kore i njihovo djelomično smanjenje, uključujući i zbog spojeva ugljika, uklanjanje ugljičnog monoksida i vode na površinu zemljine kore i njihovo učešće u reakciji fotosinteze.
Pored gore opisanog ciklusa kiseonika u nevezanom obliku, ovaj element završava i najvažniji ciklus, ulazeći u sastav vode (slika 3). Tokom ciklusa, voda isparava sa površine okeana, vodena para se kreće zajedno sa strujama vazduha, kondenzuje se, a voda se vraća u obliku padavina na površinu kopna i mora. Postoji veliki ciklus vode, u kojem se voda koja pada kao padavine na kopnu vraća u mora preko površinskog i podzemnog oticanja; i mali ciklus vode, koji taloži padavine na površini okeana.
Ciklus kiseonika prati njegov dotok i odliv.
Dolazak kiseonika obuhvata: 1) oslobađanje tokom fotosinteze; 2) formiranje u ozonskom omotaču pod uticajem UV zračenja (u malim količinama); 3) disocijacija molekula vode u gornjim slojevima atmosfere pod uticajem UV zračenja; 4) formiranje ozona – O3.
Potrošnja kiseonika obuhvata: 1) potrošnju životinja tokom disanja; 2) oksidativni procesi u zemljinoj kori; 3) oksidacija ugljen monoksida (CO) koji se oslobađa tokom vulkanskih erupcija.