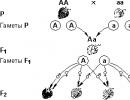
“Struktura aminokiselina, klasifikacija, svojstva, biološka uloga. Aminokiseline arginin i lizin čine Uticaj peptida na kvalitet života obične osobe
Opće karakteristike (struktura, klasifikacija, nomenklatura, izomerija).
Glavna strukturna jedinica proteina su a-amino kiseline. U prirodi postoji oko 300 aminokiselina. 20 različitih a-amino kiselina pronađeno je u proteinima (jedna od njih, prolin, nije amino-, A imino kiselina). Sve ostale aminokiseline postoje u slobodnom stanju ili u sastavu kratkih peptida, ili u kompleksima sa drugim organskim supstancama.
a-Aminokiseline su derivati karboksilnih kiselina u kojima je jedan atom vodika zamijenjen amino grupom (-NH2) na a-ugljikovom atomu, na primjer:
Aminokiseline se razlikuju po strukturi i svojstvima radikala R. Radikal može predstavljati ostatke masnih kiselina, aromatične prstenove i heterocikle. Zahvaljujući tome, svaka aminokiselina je obdarena specifičnim svojstvima koja određuju hemijska, fizička svojstva i fiziološke funkcije proteina u telu.
Zahvaljujući radikalima aminokiselina, proteini imaju niz jedinstvenih funkcija koje nisu karakteristične za druge biopolimere i imaju hemijsku individualnost.
Aminokiseline s b- ili g-pozicijom amino grupe su mnogo rjeđe u živim organizmima, na primjer:
Klasifikacija i nomenklatura aminokiselina.
Postoji nekoliko vrsta klasifikacija aminokiselina koje čine proteine.
A) Jedna od klasifikacija zasniva se na hemijskoj strukturi radikala aminokiselina. Razlikuju se aminokiseline:
1. Alifatični - glicin, alanin, valin, leucin, izoleucin:

2. Sadrže hidroksil – serin, treonin:


4. Aromatični – fenilalanin, tirozin, triptofan:
 5. Sa anjonskim grupama u bočnim lancima - asparaginska i glutaminska kiselina:
5. Sa anjonskim grupama u bočnim lancima - asparaginska i glutaminska kiselina:

6. i amidi asparaginske i glutaminske kiseline - asparagin, glutamin.

7. Glavni su arginin, histidin, lizin.
 8. Iminokiselina – prolin
8. Iminokiselina – prolin
 |
B) Druga vrsta klasifikacije zasniva se na polaritetu R grupa aminokiselina.
Razlikovati polarnih i nepolarnih amino kiseline. Nepolarni radikali imaju nepolarne C–C, C–H veze; postoji osam takvih aminokiselina: alanin, valin, leucin, izoleucin, metionin, fenilalanin, triptofan, prolin.
Sve ostale aminokiseline su na polarnu(u R-grupi postoje polarne veze C–O, C–N, –OH, S–H). Što je više aminokiselina sa polarnim grupama u proteinu, to je veća njegova reaktivnost. Funkcije proteina u velikoj mjeri zavise od njegove reaktivnosti. Enzime karakteriše posebno veliki broj polarnih grupa. I obrnuto, ima ih vrlo malo u takvom proteinu kao što je keratin (kosa, nokti).
B) Aminokiseline se takođe klasifikuju na osnovu jonskih svojstava R-grupa(Tabela 1).
Kiselo(pri pH = 7 R-grupa može nositi negativan naboj) to su asparaginska, glutaminska kiselina, cistein i tirozin.
Basic(pri pH=7 R-grupa može nositi pozitivan naboj) - to su arginin, lizin, histidin.
Sve ostale aminokiseline pripadaju neutralan (grupa R je nenapunjena).
Tabela 1 – Klasifikacija aminokiselina na osnovu polariteta
R-grupa.
R-grupe
Asparaginska kiselina
Glutaminska kiselina
4. Pozitivno napunjen
R-grupe
Histidin
G) Aminokiseline se dijele prema broju aminskih i karboksilnih grupa:
– do monoamin monokarboksilne koji sadrže jednu karboksilnu i jednu aminsku grupu;
– monoaminodikarbonske(dve karboksilne i jedna aminska grupa);
– diaminomonokarboksilna(dve aminske i jedna karboksilna grupa).
E) Prema svojoj sposobnosti da se sintetiziraju u ljudskom i životinjskom tijelu, sve aminokiseline se dijele:
– na zamjenjive,
– nezamjenjiv,
– djelimično nezamjenjiv.
Esencijalne aminokiseline ne mogu se sintetizirati u ljudskom tijelu i životinjama, one se moraju unositi hranom. Postoji osam apsolutno esencijalnih aminokiselina: valin, leucin, izoleucin, treonin, triptofan, metionin, lizin, fenilalanin.
Djelomično esencijalni – sintetiziraju se u tijelu, ali u nedovoljnim količinama, pa se moraju djelimično snabdjeti hranom. Ove aminokiseline su arganin, histidin, tirozin.
Neesencijalne aminokiseline sintetiziraju se u ljudskom tijelu u dovoljnim količinama iz drugih jedinjenja. Biljke mogu sintetizirati sve aminokiseline.
Izomerizam
U molekulima svih prirodnih aminokiselina (s izuzetkom glicina), a-ugljikov atom ima sve četiri valentne veze koje zauzimaju različiti supstituenti; takav atom ugljika je asimetričan i naziva se kiralni atom. Kao rezultat toga, otopine aminokiselina imaju optičku aktivnost - rotiraju ravninu polarizirane svjetlosti. Broj mogućih stereoizomera je tačno 2n, gdje je n broj asimetričnih atoma ugljika. Za glicin n = 0, za treonin n = 2. Svih ostalih 17 proteinskih aminokiselina sadrže jedan asimetrični atom ugljika, mogu postojati u obliku dva optička izomera.
Kao standard pri određivanju L I D- konfiguracije aminokiselina, koristi se konfiguracija stereoizomera gliceraldehida.
Lokacija u formuli Fischer projekcije NH 2 grupe na lijevoj strani odgovara L-konfiguracije, a desno – D-konfiguracije.

Treba napomenuti da su slova L I D znači da supstanca, u svojoj stereohemijskoj konfiguraciji, pripada L ili D reda, bez obzira na smjer rotacije.
Pored 20 standardnih aminokiselina koje se nalaze u gotovo svim proteinima, postoje i nestandardne aminokiseline koje su komponente samo nekih vrsta proteina – ove aminokiseline se još nazivaju modificirano(hidroksiprolin i hidroksilizin).
Metode prijema
– Aminokiseline su od izuzetnog fiziološkog značaja. Proteini i polipeptidi su građeni od ostataka aminokiselina.
Tokom hidrolize proteinaŽivotinjski i biljni organizmi proizvode aminokiseline.
Sintetičke metode za dobijanje aminokiselina:
– Utjecaj amonijaka na halogenirane kiseline

– Dobivaju se α-aminokiseline efekat amonijaka na oksinitrile
Nije tajna da za održavanje vitalnih funkcija na visokom nivou, osobi su potrebni proteini - neka vrsta građevnog materijala za tjelesna tkiva; Proteini sadrže 20 aminokiselina, čiji nazivi vjerovatno neće ništa značiti prosječnom kancelarijskom radniku. Svaka osoba, pogotovo ako govorimo o ženama, barem je jednom čula za kolagen i keratin - to su proteini koji su odgovorni za izgled noktiju, kože i kose.
Aminokiseline - šta su to?
Aminokiseline (ili aminokarboksilne kiseline; AMK; peptidi) su organska jedinjenja koja se sastoje od 16% amina - organskih derivata amonijaka - što ih razlikuje od ugljenih hidrata i lipida. Oni učestvuju u biosintezi proteina u organizmu: u probavnom sistemu, pod uticajem enzima, svi proteini koji se isporučuju hranom uništavaju se do AMC. Ukupno u prirodi postoji oko 200 peptida, ali samo 20 osnovnih aminokiselina je uključeno u izgradnju ljudskog tijela, koje se dijele na zamjenjive i esencijalne; ponekad postoji i treća vrsta - poluzamjenjiva (uvjetno zamjenjiva).

Neesencijalne aminokiseline
Zamjenjive aminokiseline su one koje se konzumiraju hranom i direktno se razmnožavaju u ljudskom tijelu iz drugih supstanci.
- Alanin je monomer bioloških jedinjenja i proteina. On provodi jedan od glavnih puteva glukogeneze, odnosno pretvara se u glukozu u jetri, i obrnuto. Veoma aktivan učesnik u metaboličkim procesima u telu.
- Arginin je aminokiselina koja se može sintetizirati u tijelu odrasle osobe, ali nije sposobna za sintezu u tijelu djeteta. Podstiče proizvodnju hormona rasta i drugih. Jedini nosilac azotnih jedinjenja u telu. Pomaže u povećanju mišićne mase i smanjenju masne mase.
- Asparagin je peptid uključen u metabolizam dušika. Tokom reakcije sa enzimom asparaginazom, on odvaja amonijak i pretvara se u asparaginsku kiselinu.
- Asparaginska kiselina - učestvuje u stvaranju imunoglobulina, deaktivira amonijak. Neophodan za poremećaje u radu nervnog i kardiovaskularnog sistema.
- Histidin - koristi se za prevenciju i liječenje gastrointestinalnih bolesti; ima pozitivnu dinamiku u borbi protiv AIDS-a. Štiti organizam od štetnih efekata stresa.
- Glicin je neurotransmiterska aminokiselina. Koristi se kao blagi sedativ i antidepresiv. Pojačava dejstvo nekih nootropnih lekova.
- Glutamin - u velikim količinama Aktivator procesa obnavljanja tkiva.
- Glutaminska kiselina - ima neurotransmiterski efekat i takođe stimuliše metaboličke procese u centralnom nervnom sistemu.
- Prolin je jedna od komponenti gotovo svih proteina. Posebno su bogate elastinom i kolagenom, koji su zaslužni za elastičnost kože.
- Serin je aminokiselina koja se nalazi u neuronima mozga i također doprinosi oslobađanju velike količine energije. To je derivat glicina.
- Tirozin je komponenta životinjskih i biljnih tkiva. Može se reproducirati iz fenilalanina djelovanjem enzima fenilalanin hidroksilaze; obrnuti proces se ne dešava.
- Cistein je jedan od sastojaka keratina, koji je odgovoran za čvrstinu i elastičnost kose, noktiju i kože. Takođe je antioksidans. Može se proizvesti od serina.
Esencijalne su aminokiseline koje se ne mogu sintetizirati u tijelu
Esencijalne aminokiseline su one koje se ne mogu proizvesti u ljudskom tijelu i mogu se opskrbiti samo hranom.
- Valin je aminokiselina koja se nalazi u gotovo svim proteinima. Povećava koordinaciju mišića i smanjuje osjetljivost tijela na promjene temperature. Održava hormon serotonin na visokom nivou.
- Izoleucin je prirodni anabolički steroid koji procesom oksidacije zasićuje mišićno i moždano tkivo energijom.
- Leucin je aminokiselina koja poboljšava metabolizam. To je svojevrsni "graditelj" strukture proteina.
- Ova tri AMK-a su dio takozvanog BCAA kompleksa, koji je posebno tražen među sportistima. Supstance iz ove grupe deluju kao izvor za povećanje mišićne mase, smanjenje masne mase i održavanje dobrog zdravlja tokom posebno intenzivne fizičke aktivnosti.
- Lizin je peptid koji ubrzava regeneraciju tkiva, proizvodnju hormona, enzima i antitijela. Odgovoran je za snagu krvnih sudova, a nalazi se u proteinima mišića i kolagenu.
- Metionin - učestvuje u sintezi holina, čiji nedostatak može dovesti do povećanog nakupljanja masti u jetri.
- Treonin - daje elastičnost i snagu tetivama. Vrlo pozitivno djeluje na srčani mišić i zubnu caklinu.
- Triptofan - podržava emocionalno stanje, jer se u tijelu pretvara u serotonin. Neophodan kod depresije i drugih psihičkih poremećaja.
- Fenilalanin - poboljšava izgled kože normalizacijom pigmentacije. Podržava psihičko blagostanje poboljšavanjem raspoloženja i unošenjem jasnoće u razmišljanje.
Druge metode za klasifikaciju peptida
Naučno, 20 esencijalnih aminokiselina podijeljeno je na osnovu polariteta njihovih bočnih lanaca, odnosno radikala. Dakle, razlikuju se četiri grupe: (ali nemaju naboj), pozitivno nabijene i negativno nabijene.
Nepolarni su: valin, alanin, leucin, izoleucin, metionin, glicin, triptofan, fenilalanin, prolin. Zauzvrat, polarne kiseline koje imaju negativan naboj uključuju asparaginsku i glutaminsku kiselinu. Polarni, koji imaju pozitivan naboj, nazivaju se arginin, histidin, lizin. Amino kiseline koje imaju polaritet, ali nemaju naboj uključuju cistein, glutamin, serin, tirozin, treonin i asparagin.

20 aminokiselina: formule (tabela)
Amino kiseline | Skraćenica | |
Asparagin | ||
Asparaginska kiselina | ||
Histidin | ||
Glutamin | ||
Glutaminska kiselina | ||
Izoleucin | ||
Metionin | ||
Triptofan | ||
fenilalanin | ||
Na osnovu ovoga, može se primijetiti da svih 20 u gornjoj tabeli) sadrže ugljik, vodonik, dušik i kisik.
Aminokiseline: učešće u ćelijskoj aktivnosti
Aminokarboksilne kiseline su uključene u biološku sintezu proteina. Biosinteza proteina je proces modeliranja polipeptidnog (“poli” - mnogo) lanca aminokiselinskih ostataka. Proces se odvija na ribosomu, organeli unutar ćelije koja je direktno odgovorna za biosintezu.

Informacije se čitaju iz dijela lanca DNK prema principu komplementarnosti (A-T, C-G); pri stvaranju m-RNA (messenger RNA, ili i-RNA - informacijska RNA - identični koncepti), dušična baza timina zamjenjuje se uracil. Zatim, koristeći isti princip, stvara se transport molekula aminokiselina do mjesta sinteze. T-RNA je kodirana tripletima (kodonima) (primjer: UAU), a ako znate kojim azotnim bazama predstavlja triplet, možete saznati koju aminokiselinu nosi.
Grupe hrane sa najvećim sadržajem AMK
Mliječni proizvodi i jaja sadrže važne tvari kao što su valin, leucin, izoleucin, arginin, triptofan, metionin i fenilalanin. Riba i bijelo meso imaju visok sadržaj valina, leucina, izoleucina, histidina, metionina, lizina, fenilalanina, triptofana. Mahunarke, žitarice i žitarice bogate su valinom, leucinom, izoleucinom, triptofanom, metioninom, treoninom, metioninom. Orašasti plodovi i razne sjemenke će zasititi tijelo treoninom, izoleucinom, lizinom, argininom i histidinom.
Ispod je sadržaj aminokiselina u nekim namirnicama.

Najveća količina triptofana i metionina može se naći u tvrdom siru, lizina - u mesu kunića, valina, leucina, izoleucina, treonina i fenilalanina - u soji. Prilikom kreiranja ishrane zasnovane na održavanju normalnog BUN-a treba obratiti pažnju na lignje i grašak, dok su po sadržaju peptida najsiromašniji krompir i kravlje mleko.
Nedostatak aminokiselina u vegetarijanstvu
Mit je da postoje aminokiseline koje se nalaze isključivo u životinjskim proizvodima. Štaviše, naučnici su otkrili da se biljni proteini apsorbuju u ljudskom tijelu bolje od životinjskih. Međutim, kada birate vegetarijanstvo kao način života, vrlo je važno pratiti svoju ishranu. Glavni problem je što sto grama mesa i ista količina pasulja sadrže različite količine BUN-a u procentima. U početku je potrebno pratiti sadržaj aminokiselina u konzumiranoj hrani, a onda bi to trebalo postati automatski.
Koliko aminokiselina treba da unosite dnevno?
U savremenom svetu apsolutno svi prehrambeni proizvodi sadrže nutrijente neophodne za čoveka, tako da nema razloga za brigu: svih 20 proteinskih aminokiselina se bezbedno snabdevaju hranom, a ta količina je dovoljna za osobu koja vodi normalan način života i barem malo prati svoju ishranu.

Ishrana sportiste mora biti zasićena proteinima, jer bez njih je jednostavno nemoguće izgraditi mišićnu masu. Fizička aktivnost dovodi do kolosalne potrošnje rezervi aminokiselina, pa su profesionalni bodibilderi primorani da uzimaju posebne suplemente. Uz intenzivnu izgradnju mišićnog reljefa, količina proteina može dostići i do sto grama proteina dnevno, ali takva dijeta nije pogodna za svakodnevnu konzumaciju. Svaki dodatak prehrani podrazumijeva upute koje sadrže različite AMK u dozama, koje se moraju pročitati prije upotrebe lijeka.
Utjecaj peptida na kvalitetu života običnog čovjeka
Potreba za proteinima nije prisutna samo kod sportista. Na primjer, proteini elastin, keratin i kolagen utiču na izgled kose, kože, noktiju, kao i na fleksibilnost i pokretljivost zglobova. Brojne aminokiseline utiču na organizam, održavajući balans masti na optimalnom nivou, obezbeđujući dovoljno energije za svakodnevni život. Uostalom, u procesu života, čak i uz najpasivniji način života, energija se troši, barem za disanje. Osim toga, kognitivna aktivnost je također nemoguća kada postoji nedostatak određenih peptida; Održavanje psihoemocionalnog stanja, između ostalog, obavlja i AMK.
Aminokiseline i sport
Ishrana profesionalnih sportista uključuje savršeno izbalansiranu ishranu koja pomaže u održavanju mišićnog tonusa. Dizajnirani posebno za one sportiste koji rade na dobijanju mišićne mase, znatno olakšavaju život.

Kao što je ranije napisano, aminokiseline su glavni gradivni blokovi proteina neophodnih za rast mišića. Takođe su u stanju da ubrzaju metabolizam i sagorevaju masnoće, što je takođe važno za lepu definiciju mišića. Kada naporno trenirate, potrebno je povećati unos BUN-a zbog činjenice da povećavaju brzinu izgradnje mišića i smanjuju bol nakon treninga.
20 aminokiselina u proteinima mogu se konzumirati i kao dio aminokarbonskih kompleksa i iz hrane. Ako odaberete uravnoteženu prehranu, tada morate uzeti u obzir apsolutno sve grame, što je teško implementirati kada je dan vrlo naporan.
Šta se dešava sa ljudskim tijelom kada postoji nedostatak ili višak aminokiselina
Glavni simptomi nedostatka aminokiselina su: loše zdravlje, nedostatak apetita, lomljivi nokti, povećan umor. Čak i uz nedostatak samog BUN-a, javlja se ogroman broj neugodnih nuspojava koje značajno narušavaju dobrobit i produktivnost.
Prezasićenost aminokiselinama može dovesti do poremećaja u radu kardiovaskularnog i nervnog sistema, što zauzvrat nije ništa manje opasno. Zauzvrat se mogu pojaviti simptomi slični trovanju hranom, što također ne znači ništa ugodno.
U svemu morate znati umjerenost, tako da održavanje zdravog načina života ne bi trebalo dovesti do viška određenih "korisnih" tvari u tijelu. Kao što je klasik napisao, „najbolje je neprijatelj dobrog“.
U članku smo pogledali formule i nazive svih 20 aminokiselina; gore je data tabela sadržaja glavnih AMA u proizvodima.
Predavanje br. 3Tema: “Aminokiseline - struktura, klasifikacija, svojstva, biološka uloga”
Aminokiseline su organska jedinjenja koja sadrže dušik čije molekule sadrže amino grupu –NH2 i karboksilnu grupu –COOH
Najjednostavniji predstavnik je aminoetanska kiselina H2N - CH2 - COOH
Klasifikacija aminokiselina
Postoje 3 glavne klasifikacije aminokiselina:
Fizičko-hemijski – na osnovu razlika u fizičko-hemijskim svojstvima aminokiselina
Hidrofobne aminokiseline (nepolarne). Komponente radikala obično sadrže ugljikovodične grupe, gdje je elektronska gustina ravnomjerno raspoređena i nema naboja ili polova. Oni također mogu sadržavati elektronegativne elemente, ali svi su u okruženju ugljikovodika.
Hidrofilne nenabijene (polarne) aminokiseline . Radikali takvih aminokiselina sadrže polarne grupe: -OH, -SH, -CONH2
Negativno nabijene aminokiseline. To uključuje asparaginsku i glutaminsku kiselinu. Imaju dodatnu COOH grupu u radikalu - u neutralnom okruženju dobijaju negativan naboj.
Pozitivno nabijene aminokiseline : arginin, lizin i histidin. Imaju dodatnu NH2 grupu (ili imidazolni prsten, poput histidina) u radikalu - u neutralnom okruženju dobijaju pozitivan naboj.
Nezamjenjivo aminokiseline, nazivaju se i “esencijalnim”. Ne mogu se sintetizirati u ljudskom tijelu i moraju se snabdjeti hranom. Ima ih 8 i još 2 aminokiseline koje se svrstavaju u djelimično esencijalne.
Djelomično nezamjenjiv: arginin, histidin.
Zamjenjiv(mogu se sintetizirati u ljudskom tijelu). Ima ih 10: glutaminska kiselina, glutamin, prolin, alanin, asparaginska kiselina, asparagin, tirozin, cistein, serin i glicin.
Aminokiseline su klasifikovane prema njihovim strukturnim karakteristikama.
1. U zavisnosti od relativnog položaja amino i karboksilnih grupa, aminokiseline se dele na α-, β-, γ-, δ-, ε- itd.

Smanjuje se potreba za aminokiselinama:
Za kongenitalne poremećaje povezane s apsorpcijom aminokiselina. U tom slučaju neke proteinske supstance mogu izazvati alergijske reakcije u organizmu, uključujući probleme u gastrointestinalnom traktu, svrab i mučnina.
Probavljivost aminokiselina
Brzina i potpunost apsorpcije aminokiselina ovisi o vrsti proizvoda koji ih sadrže. Aminokiseline sadržane u bjelanjcima, nemasnom svježem siru, nemasnom mesu i ribi tijelo dobro apsorbira.
Aminokiseline se takođe brzo apsorbuju uz odgovarajuću kombinaciju proizvoda: mleko se kombinuje sa heljdina kaša i bijeli hljeb, sve vrste proizvoda od brašna sa mesom i svježim sirom.
Korisna svojstva aminokiselina, njihov učinak na organizam
Svaka aminokiselina ima svoj uticaj na organizam. Stoga je metionin posebno važan za poboljšanje metabolizma masti u tijelu, koristi se kao prevencija ateroskleroze, ciroze i masne degeneracije jetre.
Za određene neuropsihijatrijske bolesti koriste se glutamin i aminobutirna kiselina. Glutaminska kiselina se takođe koristi u kulinarstvu kao aditiv za ukus. Cistein je indiciran za očne bolesti.
Tri glavne aminokiseline - triptofan, lizin i metionin, posebno su neophodne našem organizmu. Triptofan se koristi za ubrzanje rasta i razvoja organizma, a održava i ravnotežu dušika u tijelu.
Lizin osigurava normalan rast tijela i učestvuje u procesima stvaranja krvi.
Glavni izvori lizina i metionina su svježi sir, govedina i neke vrste riba (bakalar, smuđ, haringa). Triptofan se u optimalnim količinama nalazi u iznutricama, teletina i igra.srčani udar.
Amino kiseline za zdravlje, energiju i ljepotu
Za uspješnu izgradnju mišićne mase u bodybuildingu često se koriste kompleksi aminokiselina koji se sastoje od leucina, izoleucina i valina.
Za održavanje energije tokom treninga, sportisti koriste metionin, glicin i arginin, ili proizvode koji ih sadrže, kao dodatke ishrani.
Za svaku osobu koja vodi aktivan zdrav način života potrebna je posebna hrana koja sadrži niz esencijalnih aminokiselina za održavanje izvrsne fizičke forme, brzo vraćanje snage, sagorijevanje viška masti ili izgradnju mišićne mase.
Proteini čine materijalnu osnovu hemijske aktivnosti ćelije. Funkcije proteina u prirodi su univerzalne. Ime proteini, najprihvaćeniji termin u ruskoj književnosti odgovara terminu proteini(iz grčkog proteios- prvi). Do danas su učinjeni veliki pomaci u uspostavljanju odnosa između strukture i funkcija proteina, mehanizma njihovog učešća u najvažnijim procesima života organizma, te u razumijevanju molekularne osnove patogeneze mnogih bolesti.
U zavisnosti od njihove molekularne težine, razlikuju se peptidi i proteini. Peptidi imaju nižu molekularnu težinu od proteina. Vjerojatnije je da peptidi imaju regulatornu funkciju (hormoni, inhibitori i aktivatori enzima, transporteri jona kroz membrane, antibiotici, toksini, itd.).
12.1. α -Amino kiseline
12.1.1. Klasifikacija
Peptidi i proteini su građeni od ostataka α-aminokiselina. Ukupan broj prirodnih aminokiselina prelazi 100, ali neke od njih ima samo u određenoj zajednici organizama; 20 najvažnijih α-aminokiselina stalno se nalazi u svim proteinima (Shema 12.1).
α-Aminokiseline su heterofunkcionalna jedinjenja čiji molekuli sadrže i amino grupu i karboksilnu grupu na istom atomu ugljenika.
Šema 12.1.Najvažnije α-amino kiseline*

* Skraćenice se koriste samo za pisanje aminokiselinskih ostataka u molekulima peptida i proteina. ** Esencijalne aminokiseline.
Nazivi α-aminokiselina mogu se konstruisati koristeći supstitutivnu nomenklaturu, ali se češće koriste njihovi trivijalni nazivi.

Trivijalni nazivi za α-amino kiseline obično se povezuju sa izvorima izolacije. Serin je dio fibroina svile (od lat. serieus- svilenkasta); Tirozin je prvi put izolovan iz sira (od grč. tyros- sir); glutamin - iz glutena žitarica (od njemačkog. Gluten- ljepilo); asparaginska kiselina - iz klica šparoga (od lat. šparoge- šparoge).
Mnoge α-amino kiseline se sintetiziraju u tijelu. Neke aminokiseline neophodne za sintezu proteina ne proizvode se u tijelu i moraju doći izvana. Ove aminokiseline se nazivaju nezamjenjiv(vidi dijagram 12.1).
Esencijalne α-amino kiseline uključuju:
valin izoleucin metionin triptofan
leucin lizin treonin fenilalanin
α-Aminokiseline se klasifikuju na nekoliko načina u zavisnosti od karakteristika koje služe kao osnova za njihovu podjelu u grupe.
Jedna od karakteristika klasifikacije je hemijska priroda radikala R. Na osnovu ove karakteristike, aminokiseline se dele na alifatične, aromatične i heterociklične (vidi dijagram 12.1).
Alifatičniα -amino kiseline. Ovo je najveća grupa. Unutar njega, aminokiseline su podijeljene korištenjem dodatnih klasifikacijskih karakteristika.
U zavisnosti od broja karboksilnih grupa i amino grupa u molekuli razlikuju se:
Neutralne aminokiseline - po jedna NH grupa 2 i COOH;
Osnovne aminokiseline - dvije NH grupe 2 i jedna grupa
COOH;
Kisele aminokiseline - jedna NH 2 grupa i dvije COOH grupe.
Može se primijetiti da u grupi alifatskih neutralnih aminokiselina broj ugljikovih atoma u lancu ne prelazi šest. Istovremeno, u lancu nema aminokiselina sa četiri atoma ugljika, a aminokiseline sa pet i šest atoma ugljika imaju samo razgranatu strukturu (valin, leucin, izoleucin).
Alifatski radikal može sadržavati "dodatne" funkcionalne grupe:
Hidroksil - serin, treonin;
Karboksilne - asparaginske i glutaminske kiseline;
Tiol - cistein;
Amid - asparagin, glutamin.
Aromatičnoα -amino kiseline. U ovu grupu spadaju fenilalanin i tirozin, konstruisani na način da su benzenski prstenovi u njima odvojeni od zajedničkog fragmenta α-amino kiseline metilenskom grupom -CH 2-.

Heterociklični α -amino kiseline. Histidin i triptofan koji pripadaju ovoj grupi sadrže heterocikle - imidazol i indol. Struktura i svojstva ovih heterocikla su razmatrani u nastavku (vidjeti 13.3.1; 13.3.2). Opšti princip konstruisanja heterocikličnih aminokiselina je isti kao i aromatičnih.
Heterociklične i aromatične α-amino kiseline se mogu smatrati β-supstituisanim derivatima alanina.

Aminokiselina takođe spada u gerocikličnu prolin, u kojoj je sekundarna amino grupa uključena u pirolidin

U hemiji α-aminokiselina velika pažnja se poklanja strukturi i svojstvima “bočnih” radikala R, koji igraju važnu ulogu u formiranju strukture proteina i obavljanju njihovih bioloških funkcija. Od velikog značaja su karakteristike kao što su polaritet „bočnih“ radikala, prisustvo funkcionalnih grupa u radikalima i sposobnost ovih funkcionalnih grupa da ioniziraju.
Ovisno o bočnom radikalu, aminokiseline s nepolarni(hidrofobni) radikali i aminokiseline c polar(hidrofilni) radikali.
U prvu grupu spadaju aminokiseline sa alifatskim bočnim radikalima - alanin, valin, leucin, izoleucin, metionin - i aromatičnim bočnim radikalima - fenilalanin, triptofan.
U drugu grupu spadaju aminokiseline koje u svojim radikalima imaju polarne funkcionalne grupe koje su sposobne za jonizaciju (jonogene) ili nisu u stanju da pređu u jonsko stanje (nejonske) u tjelesnim uvjetima. Na primjer, u tirozinu je hidroksilna grupa jonska (fenolne prirode), u serinu je nejonska (alkoholne prirode).

Polarne aminokiseline sa jonskim grupama u radikalima pod određenim uslovima mogu biti u jonskom (anjonskom ili kationskom) stanju.

12.1.2. Stereoizomerizam
Glavni tip konstrukcije α-aminokiselina, odnosno veza istog atoma ugljika sa dvije različite funkcionalne grupe, radikalom i atomom vodika, sama po sebi predodređuje kiralnost α-ugljikovog atoma. Izuzetak je najjednostavnija aminokiselina glicin H 2 NCH 2 COOH, koji nema centar kiralnosti.
Konfiguracija α-amino kiselina određena je konfiguracijskim standardom - gliceraldehidom. Položaj amino grupe u formuli standardne Fischerove projekcije lijevo (slično OH grupi u l-gliceraldehidu) odgovara l-konfiguraciji, a desno - d-konfiguraciji kiralnog atoma ugljika. By R, U S-sistemu, α-ugljični atom u svim α-amino kiselinama l-serije ima S-konfiguraciju, a u d-seriji, R-konfiguraciju (izuzetak je cistein, vidi 7.1.2) .
Većina α-amino kiselina sadrži jedan asimetrični atom ugljika po molekuli i postoji kao dva optički aktivna enantiomera i jedan optički neaktivni racemat. Gotovo sve prirodne α-amino kiseline pripadaju l-seriji.

Aminokiseline izoleucin, treonin i 4-hidroksiprolin sadrže dva centra kiralnosti u molekulu.

Takve aminokiseline mogu postojati kao četiri stereoizomera, koji predstavljaju dva para enantiomera, od kojih svaki formira racemat. Za izgradnju životinjskih proteina koristi se samo jedan od enantiomera.
Stereoizomerizam izoleucina je sličan stereoizomerizmu treonina koji je prethodno razmatran (vidjeti 7.1.3). Od četiri stereoizomera, proteini sadrže l-izoleucin sa S konfiguracijom oba asimetrična atoma ugljika C-α i C-β. Imena drugog para enantiomera koji su dijastereomeri u odnosu na leucin koriste prefiks Zdravo-.

Cepanje racemata. Izvor α-aminokiselina l-serije su proteini, koji se u tu svrhu podvrgavaju hidrolitičkom cijepanju. Zbog velike potrebe za pojedinačnim enantiomerima (za sintezu proteina, lekovitih supstanci itd.) hemijski metode za razgradnju sintetičkih racemskih aminokiselina. Preferirano enzimski metoda varenja pomoću enzima. Trenutno se za odvajanje racemičnih smjesa koristi hromatografija na kiralnim sorbentima.
12.1.3. Kiselinsko-bazna svojstva
Amfoternost aminokiselina određena je kiselim (COOH) i baznim (NH). 2) funkcionalne grupe u njihovim molekulima. Aminokiseline formiraju soli i sa alkalijama i sa kiselinama.
U kristalnom stanju, α-amino kiseline postoje kao dipolarni joni H3N+ - CHR-COO- (obično korištena oznaka
Struktura aminokiseline u nejoniziranom obliku je samo radi praktičnosti).
U vodenom rastvoru aminokiseline postoje u obliku ravnotežne mešavine dipolarnih jona, katjonskih i anjonskih oblika.

Položaj ravnoteže zavisi od pH vrednosti medijuma. Za sve aminokiseline, kationski oblici prevladavaju u jako kiselim (pH 1-2) i anjonski oblici u jako alkalnim (pH > 11) sredinama.
Jonska struktura određuje niz specifičnih svojstava aminokiselina: visoku tačku topljenja (iznad 200°C), rastvorljivost u vodi i nerastvorljivost u nepolarnim organskim rastvaračima. Sposobnost većine aminokiselina da se dobro otapaju u vodi važan je faktor u osiguravanju njihovog biološkog funkcionisanja, s tim je povezana apsorpcija aminokiselina, njihov transport u tijelu itd.
Potpuno protonirana aminokiselina (kationski oblik), sa stanovišta Brønstedove teorije, je dvobazna kiselina,
Donacijom jednog protona takva dvobazna kiselina se pretvara u slabu jednobazičnu kiselinu - dipolarni ion s jednom kiselinskom grupom NH 3 + . Deprotonacija dipolarnog jona dovodi do proizvodnje anjonskog oblika aminokiseline - karboksilatnog jona, koji je Brønstedova baza. Vrijednosti karakteriziraju
Osnovna kiselinska svojstva karboksilne grupe aminokiselina obično se kreću od 1 do 3; vrijednosti pK a2 karakterizirajući kiselost amonijumske grupe - od 9 do 10 (tabela 12.1).
Tabela 12.1.Kiselinsko-bazna svojstva najvažnijih α-amino kiselina

Položaj ravnoteže, odnosno odnos različitih oblika aminokiseline, u vodenoj otopini pri određenim pH vrijednostima značajno ovisi o strukturi radikala, uglavnom o prisutnosti ionskih grupa u njemu, koje igraju ulogu dodatnih kiseli i bazični centri.
pH vrijednost pri kojoj je koncentracija dipolarnih jona maksimalna, a minimalne koncentracije kationskog i anjonskog oblika aminokiseline naziva seizoelektrična tačka (p/).
Neutralnoα -amino kiseline. Ove aminokiseline su važnepInešto niže od 7 (5,5-6,3) zbog veće sposobnosti jonizacije karboksilne grupe pod uticajem -/- efekta NH 2 grupe. Na primjer, alanin ima izoelektričnu tačku na pH 6,0.

Kiseloα -amino kiseline. Ove aminokiseline imaju dodatnu karboksilnu grupu u radikalu i nalaze se u potpuno protoniranom obliku u jako kiseloj sredini. Kisele aminokiseline su trobazne (prema Brøndstedu) sa tri značenjapK a,kao što se može vidjeti na primjeru asparaginske kiseline (p/ 3,0).

Za kisele aminokiseline (asparaginsku i glutaminsku), izoelektrična tačka je na pH mnogo nižem od 7 (vidi tabelu 12.1). U tijelu pri fiziološkim pH vrijednostima (na primjer, pH krvi 7,3-7,5), ove kiseline su u anionskom obliku, jer su obje karboksilne grupe ionizirane.
Basicα -amino kiseline. U slučaju baznih aminokiselina, izoelektrične tačke se nalaze u pH području iznad 7. U jako kiseloj sredini, ova jedinjenja su i trobazne kiseline, čije su faze jonizacije ilustrovane na primeru lizina (p/ 9.8) .

U tijelu se bazične aminokiseline nalaze u obliku kationa, odnosno obje amino grupe su protonirane.
Općenito, nema α-amino kiseline in vivonije na svojoj izoelektričnoj tački i ne pada u stanje koje odgovara najnižoj rastvorljivosti u vodi. Sve aminokiseline u tijelu su u jonskom obliku.
12.1.4. Analitički važne reakcije α -amino kiseline
α-Aminokiseline, kao heterofunkcionalna jedinjenja, ulaze u reakcije karakteristične i za karboksilnu i za amino grupu. Neka hemijska svojstva aminokiselina su posledica funkcionalnih grupa u radikalu. Ovaj dio govori o reakcijama koje su od praktične važnosti za identifikaciju i analizu aminokiselina.
Esterifikacija.Kada aminokiseline reaguju s alkoholima u prisustvu kiselog katalizatora (na primjer, plinovitog hlorovodonika), dobijaju se estri u obliku hidrohlorida sa dobrim prinosom. Da bi se izolovali slobodni esteri, reakciona smeša se tretira gasovitim amonijakom.

Estri aminokiselina nemaju dipolarnu strukturu, pa se, za razliku od matičnih kiselina, rastvaraju u organskim rastvaračima i isparljivi su. Dakle, glicin je kristalna supstanca sa visokom tačkom topljenja (292°C), a njegov metil ester je tečnost sa tačkom ključanja od 130°C. Analiza estera aminokiselina može se provesti plinsko-tečnom hromatografijom.
Reakcija sa formaldehidom. Od praktičnog značaja je reakcija sa formaldehidom, koja je u osnovi kvantitativnog određivanja aminokiselina metodom formol titracija(Sørensenova metoda).
Amfoterna priroda aminokiselina ne dozvoljava direktnu titraciju alkalijama u analitičke svrhe. Interakcija aminokiselina sa formaldehidom proizvodi relativno stabilne amino alkohole (vidi 5.3) - N-hidroksimetil derivate, čija se slobodna karboksilna grupa zatim titrira alkalijom.
Kvalitativne reakcije. Karakteristika hemije aminokiselina i proteina je upotreba brojnih kvalitativnih (bojnih) reakcija, koje su prethodno činile osnovu hemijske analize. Danas, kada se istraživanja provode pomoću fizičko-hemijskih metoda, mnoge kvalitativne reakcije i dalje se koriste za detekciju α-amino kiselina, na primjer, u hromatografskoj analizi.
Chelation. Sa katjonima teških metala, α-aminokiseline kao bifunkcionalna jedinjenja formiraju unutarkompleksne soli, na primjer, sa svježe pripremljenim bakar(11) hidroksidom u blagim uvjetima, dobijaju se dobro kristalizirajući kelati
soli plavog bakra(11) (jedna od nespecifičnih metoda za detekciju α-amino kiselina).

Ninhidrinska reakcija. Opća kvalitativna reakcija α-amino kiselina je reakcija s ninhidrinom. Reakcioni proizvod ima plavo-ljubičastu boju, koja se koristi za vizuelnu detekciju aminokiselina na hromatogramima (na papiru, u tankom sloju), kao i za spektrofotometrijsko određivanje na analizatorima aminokiselina (proizvod apsorbuje svetlost u oblasti 550-570 nm).

Deaminacija. U laboratorijskim uslovima, ova reakcija se odvija djelovanjem dušične kiseline na α-amino kiseline (vidjeti 4.3). U tom slučaju nastaje odgovarajuća α-hidroksi kiselina i oslobađa se plin dušik, čija se zapremina koristi za određivanje količine aminokiseline koja je reagirala (Van-Slyke metoda).
Ksantoproteinska reakcija. Ova reakcija se koristi za otkrivanje aromatičnih i heterocikličkih aminokiselina - fenilalanin, tirozin, histidin, triptofan. Na primjer, kada koncentrirana dušična kiselina djeluje na tirozin, nastaje nitro derivat, obojen žuto. U alkalnoj sredini, boja postaje narandžasta zbog jonizacije fenolne hidroksilne grupe i povećanja doprinosa anjona konjugaciji.

Postoji i niz privatnih reakcija koje omogućavaju otkrivanje pojedinačnih aminokiselina.
Triptofan detektovan reakcijom sa p-(dimetilamino)benzaldehidom u sumpornoj kiselini pojavom crveno-ljubičaste boje (Ehrlichova reakcija). Ova reakcija se koristi za kvantitativnu analizu triptofana u produktima razgradnje proteina.
Cistein otkriven kroz nekoliko kvalitativnih reakcija na osnovu reaktivnosti merkapto grupe koju sadrži. Na primjer, kada se otopina proteina s olovnim acetatom (CH3COO)2Pb zagrije u alkalnom mediju, nastaje crni talog olovnog sulfida PbS, što ukazuje na prisutnost cisteina u proteinima.
12.1.5. Biološki važne hemijske reakcije
U organizmu se pod uticajem različitih enzima odvija niz važnih hemijskih transformacija aminokiselina. Takve transformacije uključuju transaminaciju, dekarboksilaciju, eliminaciju, cijepanje aldola, oksidativnu deaminaciju i oksidaciju tiolnih grupa.
Transaminacija je glavni put za biosintezu α-amino kiselina iz α-oksokiselina. Donator amino grupe je amino kiselina prisutna u ćelijama u dovoljnoj količini ili višku, a njen akceptor je α-oksokiselina. U tom slučaju aminokiselina se pretvara u oksokiselinu, a oksokiselina u aminokiselinu s odgovarajućom strukturom radikala. Kao rezultat toga, transaminacija je reverzibilan proces zamjene amino i okso grupa. Primjer takve reakcije je proizvodnja l-glutaminske kiseline iz 2-oksoglutarne kiseline. Donorska aminokiselina može biti, na primjer, l-asparaginska kiselina.

α-Aminokiseline sadrže amino grupu koja povlači elektrone (tačnije, protoniranu amino grupu NH) na α-položaju prema karboksilnoj grupi 3 +), i stoga sposoban za dekarboksilaciju.
Eliminacijakarakterističan za aminokiseline kod kojih bočni radikal na β-položaju karboksilne grupe sadrži funkcionalnu grupu koja povlači elektrone, na primjer, hidroksil ili tiol. Njihova eliminacija dovodi do srednje reaktivnih α-enamino kiselina, koje se lako transformišu u tautomerne iminokiseline (analogija sa keto-enol tautomerizmom). Kao rezultat hidratacije na C=N vezi i naknadne eliminacije molekula amonijaka, α-imino kiseline se pretvaraju u α-okso kiseline.

Ova vrsta transformacije se zove eliminacija-hidratacija. Primjer je proizvodnja pirogrožđane kiseline iz serina.
Aldol cijepanje javlja se u slučaju α-aminokiselina, koje sadrže hidroksilnu grupu na β-položaju. Na primjer, serin se razgrađuje u glicin i formaldehid (potonji se ne oslobađa u slobodnom obliku, već se odmah vezuje za koenzim).
Oksidativna deaminacija može se izvesti uz učešće enzima i koenzima NAD+ ili NADP+ (vidi 14.3). α-Aminokiseline se mogu pretvoriti u α-oksokiseline ne samo transaminacijom, već i oksidativnom deaminacijom. Na primjer, α-oksoglutarna kiselina nastaje iz l-glutaminske kiseline. U prvoj fazi reakcije glutaminska kiselina se dehidrogenira (oksidira) u α-iminoglutarnu kiselinu
kiseline. U drugoj fazi dolazi do hidrolize, što rezultira α-oksoglutarnom kiselinom i amonijakom. Faza hidrolize se odvija bez učešća enzima.

Reakcija reduktivne aminacije α-okso kiselina odvija se u suprotnom smjeru. α-oksoglutarna kiselina, koja se uvijek nalazi u stanicama (kao produkt metabolizma ugljikohidrata), na taj se način pretvara u L-glutaminsku kiselinu.
Oksidacija tiolnih grupa leži u osnovi međukonverzije cisteina i cistinskih ostataka, osiguravajući niz redoks procesa u ćeliji. Cistein, kao i svi tioli (vidjeti 4.1.2), lako se oksidira u disulfid, cistin. Disulfidna veza u cistinu se lako reducira u cistein.

Zbog sposobnosti tiolne grupe da lako oksidira, cistein obavlja zaštitnu funkciju kada je tijelo izloženo tvarima visokog oksidativnog kapaciteta. Osim toga, to je bio prvi lijek koji je pokazao djelovanje protiv zračenja. Cistein se u farmaceutskoj praksi koristi kao stabilizator za lijekove.
Konverzija cisteina u cistin rezultira stvaranjem disulfidnih veza, kao što je smanjeni glutation
(vidi 12.2.3).
12.2. Primarna struktura peptida i proteina
Uobičajeno se vjeruje da peptidi sadrže do 100 aminokiselinskih ostataka u molekulu (što odgovara molekulskoj težini do 10 hiljada), a proteini sadrže više od 100 aminokiselinskih ostataka (molekularna težina od 10 hiljada do nekoliko miliona) .
Zauzvrat, u grupi peptida uobičajeno je razlikovati oligopeptidi(peptidi male molekularne težine) koji ne sadrže više od 10 aminokiselinskih ostataka u lancu, i polipeptidi,čiji lanac uključuje do 100 aminokiselinskih ostataka. Makromolekule s brojem aminokiselinskih ostataka koji se približava ili malo prelazi 100 ne prave razliku između polipeptida i proteina; ovi termini se često koriste kao sinonimi.
Molekul peptida i proteina se formalno može predstaviti kao proizvod polikondenzacije α-amino kiselina, koja nastaje formiranjem peptidne (amidne) veze između monomernih jedinica (Shema 12.2).
Dizajn poliamidnog lanca je isti za čitav niz peptida i proteina. Ovaj lanac ima nerazgranatu strukturu i sastoji se od naizmjeničnih peptidnih (amidnih) grupa -CO-NH- i fragmenata -CH(R)-.
Jedan kraj lanca sadrži aminokiselinu sa slobodnom NH grupom 2, se zove N-terminus, drugi se zove C-terminus,
Šema 12.2.Princip izgradnje peptidnog lanca

koji sadrži aminokiselinu sa slobodnom COOH grupom. Peptidni i proteinski lanci su napisani sa N-kraja.
12.2.1. Struktura peptidne grupe
U peptidnoj (amidnoj) grupi -CO-NH- atom ugljika je u stanju sp2 hibridizacije. Usamljeni par elektrona atoma dušika ulazi u konjugaciju sa π-elektronima dvostruke veze C=O. Sa stanovišta elektronske strukture, peptidna grupa je trocentrični p,π-konjugovani sistem (videti 2.3.1), u kome je elektronska gustina pomerena ka elektronegativnijem atomu kiseonika. C, O i N atomi koji formiraju konjugirani sistem nalaze se u istoj ravni. Distribucija elektronske gustine u amidnoj grupi može se predstaviti korišćenjem graničnih struktura (I) i (II) ili pomeranja elektronske gustine kao rezultat +M- i -M-efekta NH i C=O grupa, respektivno (III).

Kao rezultat konjugacije, dolazi do određenog poravnanja dužina veza. Dvostruka veza C=O se produžava na 0,124 nm u poređenju sa uobičajenom dužinom od 0,121 nm, a C-N veza postaje kraća - 0,132 nm u poređenju sa 0,147 nm u uobičajenom slučaju (Slika 12.1). Planarni konjugovani sistem u peptidnoj grupi uzrokuje poteškoće u rotaciji oko C-N veze (barijera rotacije je 63-84 kJ/mol). Dakle, elektronska struktura određuje prilično krut stan struktura peptidne grupe.
Kao što se može videti sa sl. 12.1, α-ugljični atomi aminokiselinskih ostataka nalaze se u ravnini peptidne grupe na suprotnim stranama C-N veze, odnosno u povoljnijem trans položaju: bočni radikali R aminokiselinskih ostataka u ovom slučaju će biti najudaljenije jedna od druge u svemiru.
Polipeptidni lanac ima iznenađujuće ujednačenu strukturu i može se predstaviti kao niz jedan drugog koji se nalazi pod uglom.

Rice. 12.1.Planarni raspored peptidne grupe -CO-NH- i α-ugljikovih atoma aminokiselinskih ostataka
jedna na drugu ravni peptidnih grupa koje su međusobno povezane preko α-ugljičnih atoma Cα-N i Cα-Csp vezama 2 (Sl. 12.2). Rotacija oko ovih pojedinačnih veza je vrlo ograničena zbog poteškoća u prostornom smještaju bočnih radikala aminokiselinskih ostataka. Dakle, elektronska i prostorna struktura peptidne grupe u velikoj mjeri određuje strukturu polipeptidnog lanca u cjelini.

Rice. 12.2.Relativni položaj ravni peptidnih grupa u polipeptidnom lancu
12.2.2. Sastav i sekvenca aminokiselina
Sa ujednačeno izgrađenim poliamidnim lancem, specifičnost peptida i proteina određena je dvije najvažnije karakteristike - sastavom aminokiselina i sekvencom aminokiselina.
Sastav aminokiselina peptida i proteina je priroda i kvantitativni odnos njihovih α-amino kiselina.
Sastav aminokiselina određuje se analizom hidrolizata peptida i proteina, uglavnom hromatografskim metodama. Trenutno se takva analiza provodi pomoću analizatora aminokiselina.
Amidne veze su sposobne za hidrolizu i u kiselim i u alkalnim sredinama (vidjeti 8.3.3). Peptidi i proteini se hidroliziraju kako bi formirali ili kraće lance - to je tzv djelomična hidroliza, ili mješavina aminokiselina (u jonskom obliku) - potpuna hidroliza. Hidroliza se obično izvodi u kiseloj sredini, jer su mnoge aminokiseline nestabilne u uslovima alkalne hidrolize. Treba napomenuti da su amidne grupe asparagina i glutamina također podložne hidrolizi.

Primarna struktura peptida i proteina je aminokiselinska sekvenca, odnosno red alternacije α-aminokiselinskih ostataka.
Primarna struktura je određena uzastopnim uklanjanjem aminokiselina sa oba kraja lanca i njihovom identifikacijom.
12.2.3. Struktura i nomenklatura peptida
Imena peptida se konstruišu uzastopnim navođenjem aminokiselinskih ostataka, počevši od N-kraja, uz dodatak sufiksa-il, osim posljednje C-terminalne aminokiseline, za koju je zadržan njen puni naziv. Drugim riječima, imena
aminokiseline koje su ušle u formiranje peptidne veze zbog "njihove" COOH grupe završavaju se imenom peptida sa -il: alanil, valil itd. (za ostatke asparaginske i glutaminske kiseline koriste se nazivi “aspartil” i “glutamil”). Nazivi i simboli aminokiselina ukazuju na njihovu pripadnost l -red, osim ako nije drugačije naznačeno ( d ili dl).

Ponekad u skraćenom zapisu simboli H (kao dio amino grupe) i OH (kao dio karboksilne grupe) označavaju nesupstituciju funkcionalnih grupa terminalnih aminokiselina. Ova metoda je pogodna za prikazivanje funkcionalnih derivata peptida; na primjer, amid gornjeg peptida na C-terminalnoj aminokiselini je napisan H-Asn-Gly-Phe-NH2.
Peptidi se nalaze u svim organizmima. Za razliku od proteina, oni imaju heterogeniji sastav aminokiselina, posebno često uključuju aminokiseline d -red. Strukturno su također raznovrsniji: sadrže cikličke fragmente, razgranate lance itd.
Jedan od najčešćih predstavnika tripeptida je glutation- nalazi se u tijelu svih životinja, biljaka i bakterija.

Cistein u sastavu glutationa omogućava da glutation postoji iu redukovanom i u oksidiranom obliku.

Glutation je uključen u brojne redoks procese. Funkcionira kao proteinski protektor, odnosno supstanca koja štiti proteine sa slobodnim SH tiolnim grupama od oksidacije sa stvaranjem disulfidnih veza -S-S-. Ovo se odnosi na one proteine za koje je takav proces nepoželjan. U tim slučajevima glutation preuzima djelovanje oksidacijskog sredstva i tako „štiti“ protein. Tokom oksidacije glutationa dolazi do intermolekularnog umrežavanja dva tripeptidna fragmenta zbog disulfidne veze. Proces je reverzibilan.
12.3. Sekundarna struktura polipeptida i proteina
Polipeptide i proteine visoke molekularne težine, uz primarnu strukturu, karakterišu i viši nivoi organizacije, koji se nazivaju sekundarno, tercijarno I kvartarni strukture.
Sekundarna struktura je opisana prostornom orijentacijom glavnog polipeptidnog lanca, a tercijarna struktura trodimenzionalnom arhitekturom cijelog proteinskog molekula. I sekundarna i tercijarna struktura povezane su s uređenim rasporedom makromolekularnog lanca u prostoru. Tercijarna i kvartarna struktura proteina razmatra se u kursu biohemije.
Proračunom je pokazano da je jedna od najpovoljnijih konformacija za polipeptidni lanac raspored u prostoru u obliku desne spirale, tzv. α-heliks(Sl. 12.3, a).
Prostorni raspored α-heličnog polipeptidnog lanca može se zamisliti zamišljanjem da se obavija oko određenog

Rice. 12.3.α-helikalna konformacija polipeptidnog lanca
cilindar (vidi sliku 12.3, b). U prosjeku ima 3,6 aminokiselinskih ostataka po okretu spirale, korak spirale je 0,54 nm, a prečnik je 0,5 nm. Ravnine dvije susjedne peptidne grupe nalaze se pod kutom od 108°, a bočni radikali aminokiselina nalaze se na vanjskoj strani zavojnice, odnosno usmjereni su kao sa površine cilindra.
Glavnu ulogu u obezbeđivanju takve konformacije lanca imaju vodonične veze, koje u α-helixu nastaju između karbonilnog atoma kiseonika svakog prvog i atoma vodika NH grupe svakog petog aminokiselinskog ostatka.

Vodikove veze su usmjerene gotovo paralelno sa osom α-heliksa. Oni drže lanac uvijenim.
Tipično, proteinski lanci nisu potpuno spiralni, već samo djelomično. Proteini kao što su mioglobin i hemoglobin sadrže prilično duge α-helične regije, kao što je lanac mioglobina
75% spiralizirano. U mnogim drugim proteinima, udio spiralnih regija u lancu može biti mali.
Druga vrsta sekundarne strukture polipeptida i proteina je β-struktura, takođe pozvan presavijeni list, ili presavijeni sloj. Izduženi polipeptidni lanci su raspoređeni u presavijene listove, povezani mnogim vodoničnim vezama između peptidnih grupa ovih lanaca (slika 12.4). Mnogi proteini sadrže i α-helikalne i β-liste strukture.

Rice. 12.4.Sekundarna struktura polipeptidnog lanca u obliku presavijenog lista (β-struktura)
Moderna proteinska prehrana ne može se zamisliti bez razmatranja uloge pojedinih aminokiselina. Čak i uz ukupnu pozitivnu ravnotežu proteina, tijelo životinje može osjetiti nedostatak proteina. To je zbog činjenice da je apsorpcija pojedinih aminokiselina međusobno povezana; nedostatak ili višak jedne aminokiseline može dovesti do nedostatka druge.
Neke aminokiseline se ne sintetiziraju u ljudskom i životinjskom tijelu. Nazivaju se nezamjenjivim. Postoji samo deset takvih aminokiselina. Četiri od njih su kritična (ograničavajuća) - najčešće ograničavaju rast i razvoj životinja.
U ishrani za živinu glavne ograničavajuće aminokiseline su metionin i cistin, u ishrani za svinje – lizin. Tijelo mora s hranom primiti dovoljnu količinu glavne ograničavajuće kiseline kako bi se druge aminokiseline mogle efikasno koristiti za sintezu proteina.
Ovaj princip ilustruje "Liebig bure", gdje nivo punjenja bureta predstavlja nivo sinteze proteina u tijelu životinje. Najkraća daska u buretu „ograničava“ mogućnost zadržavanja tečnosti u njoj. Ako se ova ploča produži, tada će se volumen tekućine koja se drži u buretu povećati do nivoa druge granične ploče.
Najvažniji faktor koji određuje produktivnost životinja je ravnoteža aminokiselina koje sadrži u skladu sa fiziološkim potrebama. Brojna istraživanja su dokazala da se kod svinja, ovisno o rasi i spolu, potreba za aminokiselinama kvantitativno razlikuje. Ali omjer esencijalnih aminokiselina za sintezu 1 g proteina je isti. Ovaj omjer esencijalnih aminokiselina i lizina, kao glavne ograničavajuće aminokiseline, naziva se “idealni protein” ili “idealni aminokiselinski profil”. (
Lysine
dio je gotovo svih proteina životinjskog, biljnog i mikrobnog porijekla, ali proteini žitarica su siromašni lizinom.
- Lizin reguliše reproduktivnu funkciju, njegov nedostatak remeti stvaranje spermatozoida i jajnih ćelija.
- Neophodan za rast mladih životinja i stvaranje proteina tkiva. Lizin učestvuje u sintezi nukleoproteina, hromoproteina (hemoglobina), čime reguliše pigmentaciju životinjskog krzna. Reguliše količinu proizvoda razgradnje proteina u tkivima i organima.
- Promoviše apsorpciju kalcijuma
- Učestvuje u funkcionalnoj aktivnosti nervnog i endokrinog sistema, reguliše metabolizam proteina i ugljenih hidrata, međutim, kada reaguje sa ugljenim hidratima, lizin postaje nepristupačan za apsorpciju.
- Lizin je polazna tvar u stvaranju karnitina, koji igra važnu ulogu u metabolizmu masti.
Metionin i cistin aminokiseline koje sadrže sumpor. U tom slučaju metionin se može transformirati u cistin, pa se te aminokiseline racioniraju zajedno, a ako postoji nedostatak, u prehranu se unose suplementi metionina. Obje ove aminokiseline su uključene u formiranje kožnih derivata - kose, perja; zajedno s vitaminom E reguliraju uklanjanje viška masnoće iz jetre i neophodni su za rast i reprodukciju stanica i crvenih krvnih stanica. Ako postoji nedostatak metionina, cistin je neaktivan. Međutim, ne bi trebalo dozvoliti značajan višak metionina u ishrani.
Metionin
pospješuje taloženje masti u mišićima, neophodan je za stvaranje novih organskih spojeva holina (vitamin B4), kreatina, adrenalina, niacina (vitamin B5) itd.
Nedostatak metionina u ishrani dovodi do smanjenja nivoa proteina plazme (albumina), izaziva anemiju (smanjuje se nivo hemoglobina u krvi), dok istovremeni nedostatak vitamina E i selena doprinosi razvoju mišićne distrofije. Nedovoljna količina metionina u ishrani uzrokuje usporavanje rasta mladih životinja, gubitak apetita, smanjenu produktivnost, povećanje troškova hrane, masnu jetru, oštećenje funkcije bubrega, anemiju i mršavljenje.
Višak metionina otežava korištenje dušika, uzrokuje degenerativne promjene u jetri, bubrezima, gušterači i povećava potrebu za argininom i glicinom. Kod velikog viška metionina uočava se neravnoteža (poremećena je ravnoteža aminokiselina, koja se temelji na oštrim odstupanjima od optimalnog omjera esencijalnih aminokiselina u prehrani), što je praćeno metaboličkim poremećajima i inhibicijom brzine rasta. kod mladih životinja.
Cistin je aminokiselina koja sadrži sumpor, zamjenjiva s metioninom, učestvuje u redoks procesima, metabolizmu proteina, ugljikohidrata i žučnih kiselina, potiče stvaranje tvari koje neutraliziraju crijevne otrove, aktivira inzulin, zajedno sa triptofanom, cistin sudjeluje u sintezi u jetri žučne kiseline neophodne za apsorpciju produkata probave masti iz crijeva, koje se koriste za sintezu glutationa. Cistin ima sposobnost da apsorbuje ultraljubičaste zrake. Uz nedostatak cistina dolazi do ciroze jetre, usporenog perjanja i rasta perja kod mladih jedinki, krhkosti i gubitka (čupanja) perja kod odraslih ptica, te smanjene otpornosti na zarazne bolesti.
Triptofan
određuje fiziološku aktivnost enzima probavnog trakta, oksidativne enzime u ćelijama i niz hormona, učestvuje u obnavljanju proteina krvne plazme, određuje normalno funkcionisanje endokrinog i hematopoetskog aparata, reproduktivnog sistema, sintezu gama globulina , hemoglobin, nikotinska kiselina, očna ljubičasta itd. U slučaju nedostatka u ishrani triptofana usporava se rast mladih životinja, smanjuje se proizvodnja jaja nesilica, povećavaju se troškovi hrane za proizvodnju, atrofiraju endokrine i spolne žlijezde , dolazi do sljepoće, razvija se anemija (smanjuje se broj crvenih krvnih zrnaca i nivo hemoglobina u krvi), smanjuje se otpornost i imunološka svojstva organizma, oplodnja i valivost jaja. Kod svinja hranjenih hranom sa malo triptofana, smanjuje se unos hrane, pojavljuje se izopačen apetit, čekinje postaju grublje i mršave, a primjećuje se masna jetra. Nedostatak ove aminokiseline također dovodi do steriliteta, povećane razdražljivosti, konvulzija, stvaranja katarakte, negativnog balansa dušika i gubitka žive težine. Triptofan, kao prekursor (provitamin) nikotinske kiseline, sprečava razvoj pelagre.